فرمول ماده معدنی که. ترکیب شیمیایی کانی ها، محاسبه فرمول ها
هر ماده معدنی ترکیب شیمیایی خاصی دارد. ممکن است از یک عنصر شیمیایی یا چند عنصر تشکیل شده باشد. اگر یک کانی از یک عنصر شیمیایی تشکیل شده باشد به آن عنصر بومی می گویند. به عنوان مثال، نقره بومی، بومی، بومی و غیره. با این حال، اکثر کانی ها از چندین عنصر شیمیایی و گاهی اوقات بسیاری از عناصر شیمیایی تشکیل شده اند. ترکیب کانی ها معمولاً به صورت فرمول شیمیایی یا درصد وزنی بیان می شود که با استفاده از تجزیه و تحلیل شیمیایی تعیین می شود.
مثلا، ترکیب شیمیاییکانیهای کالکوپیریت و آنالسیم را میتوان به صورت درصد وزنی عناصر شیمیایی (برای اولی) یا اکسیدها (برای دومی) بیان کرد:
I. (Cu - 34.9) + (Fe - 30.47) + (S - 34.6) = مجموع 99.97
II. (SiO 2 - 55.12) + (Al 2 O 3 - 22.99) + (Na 2 O - 13.53) + (H 2 O - 8.27) = مجموع 99.81
فرمول این مواد معدنی با تقسیم مقادیر وزن مشخص شده بر وزن اتمی یا مولکولی مربوطه محاسبه می شود. در این صورت کمیت های اتمی یا مولکولی به دست می آید. جرم اتمی عناصر شیمیایی از جدول سیستم تناوبی عناصر D.I. مندلیف گرفته شده است، وزن مولکولی اکسید با جمع کردن جرم های اتمی که اکسید مربوطه عناصر را تشکیل می دهند به دست می آید. مقادیر اتمی یا مولکولی با ضرایب متناسب آنها در فرمول حاصل جایگزین می شوند. نمونه هایی از محاسبه فرمول کالکوپیریت و آنالسیم در جدول آورده شده است. 7.
فرمول های به دست آمده در حین محاسبه و ارائه ایده ای از ترکیب شیمیایی ماده معدنی، تجربی نامیده می شوند. اینها فرمولهای بدست آمده از کالکوپیریت و آنالسیم - 4Si02 Al203 NagO 2H20 هستند. فرمول تجربی آنالسیم که به شکل اکسید نوشته شده است، روابط بین عناصر شیمیایی را منعکس نمی کند و چیزی در مورد ساختار ماده معدنی نمی گوید؛ این نوشتن فرمول یک مزیت دارد - به خاطر سپردن آن آسان تر است.
| محاسبه مجدد داده های آنالیز شیمیایی و ایجاد فرمول معدنی جدول 7 | ||||
| اجزاء | درصد وزن | کمیت های اتمی (مولکولی). | روابط بین کمیت های اتم (مولکولی). | نام و فرمول ماده معدنی |
| مس | 34,9 | 34,9: 63,5 = 0,550 | 1 | CuFeS2 |
| Fe | 30,47 | 30,47: 55,8 = 0,546 | 1 | |
| اس | 34,6 | 34,6: 32 = 1,081 | 2 | |
| SiO2 | 55,12 | 55,12: 60 = 0,919 | 4 | 4SiO2 Al2O3 Na2O 2H2O |
| Al2O3 | 22,99 | 22,99: 102 = 0,225 | 1 | |
| Na2O | 13,53 | 13,53: 62 = 0,218 | 1 | |
| H2O | 8,27 | 8,27: 18 = 0,459 | 2 | |
برای تعدادی از کانی ها، معمولاً فرمول هایی نوشته می شود که نوع ترکیب شیمیایی و پیوندهای متقابل بین عناصر شیمیایی تشکیل دهنده را منعکس می کند. به چنین فرمول هایی مواد شیمیایی ساختاری یا کریستالی می گویند. فرمول آنالسیم Na H 2 O است. ساختاری است. براکت های مربع رادیکال را برجسته می کنند که نشان دهنده یک کمپلکس آنیونی پیچیده است که در ماده معدنی به مقدار یک مولکول وجود دارد، در انتهای فرمول نوشته شده و با یک نقطه از آن جدا می شود. مثالی دیگر. فرمول تجربی مسکوویت H 2 KAl 3 Si 3 O 12 است، فرمول ساختاری KAl 2 (OH, F) 2 است. در این فرمول، یک کمپلکس آنیونی پیچیده به عنوان یک رادیکال جدا می شود و در کانی نه به شکل H 2 O، بلکه به شکل هیدروکسیل (OH) - وجود دارد که می تواند از کاما دیگری جایگزین شود. عنصر شیمیایی در وهله اول در براکت ها به مقدار بیشتری وجود دارد. به عنوان مثال، فرمول آنکریت Ca (Mg, Fe) 2 2 است. آنالیز پراش اشعه ایکس اکنون امکان ایجاد فرمول های ساختاری بسیاری از کانی ها را فراهم کرده است.
مفهوم مواد معدنی و کانی شناسی
مواد معدنی مواد طبیعی (ترکیبات شیمیایی، کمتر عناصر) با خواص شیمیایی و فیزیکی خاص هستند. ماده معدنی به معنای قطعه سنگ، قطعه سنگ است.
سنگهایی مانند گرانیت نیز محصول فرآیندهای زمینشناسی است پوسته زمینرا نمی توان کانی نامید، زیرا از نظر فیزیکی و شیمیایی ناهمگن است بخش های مختلف. گرانیت شامل کوارتز با ترکیب و ساختار و فلدسپات، میکا است که با کوارتز و با یکدیگر تفاوت دارند.
کانی شناسی علمی است که به مطالعه کانی ها می پردازد. کانی شناسی مدرن منشاء (پیدایش) کانی ها، الگوهای توزیع آنها در طبیعت (پاراژنز) و همچنین شرایط تبدیل آنها به کانی های دیگر را مطالعه می کند، زیرا هر یک از کانی ها در محدوده خاصی از دما تشکیل شده و پایدار است. فشار و غلظت عناصر شیمیایی وظیفه کانی شناسی همچنین شامل مطالعه مورفولوژی (ظاهر) است. مشخصات فیزیکی، ترکیب شیمیایی و ساختار داخلی کانی ها.
مواد معدنی در اقتصاد ملی مهم هستند: آنها به عنوان مصالح ساختمانی، گرانبها و سنگ های نیمه قیمتی، سنگ معدن فلزات آهنی، غیر آهنی و کمیاب، سنگ معدن کشاورزی و غیره.
جستجوی آنها فقط بر اساس آگاهی از قوانین تشکیل مواد معدنی در یک محیط طبیعی خاص عقلانی است.
کانی شناسی ارتباط نزدیکی با کل چرخه علوم زمین شناسی دارد: زمین شناسی، پتروگرافی و ژئوشیمی، مطالعه کانی ها. کانی شناسی همچنین با چرخه علوم فیزیکی و شیمیایی مرتبط است: شیمی، فیزیک، کریستالوگرافی.
پوسته زمین از مواد معدنی تشکیل شده است. حدود 2000 نفر از آنها شناخته شده است. بیشترمواد معدنی در طبیعت در حالت جامد هستند. مواد معدنی مایع (جیوه، آب، نفت و غیره) و گازی ( دی اکسید کربنگازهای قابل احتراق، سولفید هیدروژن، دی اکسید گوگرد و غیره).
مردم مدتهاست یاد گرفتهاند که محصولات مصنوعی بسازند که از نظر خواص، ترکیب و ساختار مشابه مواد معدنی باشد. به آنها کانی های مصنوعی می گویند (به عنوان مثال، کوارتز، کوراندوم، میکا و غیره).
نام کانی ها بر اساس ویژگی های فیزیکی مشخصه (مثلا مگنتیت)، ترکیب شیمیایی (پیریت های گوگردی) یا محل اولین کشف (لابرادور، پس از نام شبه جزیره لابرادور در سال 1998) داده شده است. آمریکای شمالی، به افتخار دانشمندان یا شخصیت های عمومی (بیوتیت - میکای سیاه، به افتخار فیزیکدان Biot). اکثر کانی ها چندین نام دارند.
^
ترکیب شیمیایی و فرمول مواد معدنی
ترکیب ماده معدنی با تجزیه و تحلیل شیمیایی در آزمایشگاه تعیین می شود. ابتدا محتوای اکسیدها یا عناصر منفرد به صورت درصد تعیین می شود سپس داده های به دست آمده با فرمول شیمیایی کانی بیان می شود.
به عنوان مثال، تجزیه و تحلیل شیمیایی پیریت مس (کالکوپیریت) ترکیب زیر را به دست می دهد: Fe = 30.27٪. مس= 34.98%; S = 35.75%.
برای تعیین فرمول شیمیایی، لازم است اعداد به دست آمده در طول تجزیه و تحلیل بر وزن اتمی یا مولکولی مربوطه تقسیم شود. در مرحله بعد، مقادیر اتمی یا مولکولی عناصر یا اکسیدها با یکدیگر مقایسه شده و نسبتهای چندگانه آنها یافت میشود. آنها به عنوان ضرایب در فرمول شیمیایی ماده معدنی عمل می کنند (جدول 3).
جدول 3
نمونه ای از تعیین فرمول کالکوپیریت
| عناصر شیمیایی | مقدار ماده، % | کمیت های اتمی | نسبت بین کمیت های اتمی | فرمول |
| Fe | 30,27 | 1 | CuFeS 2 |
|
| مس | 34,98 | 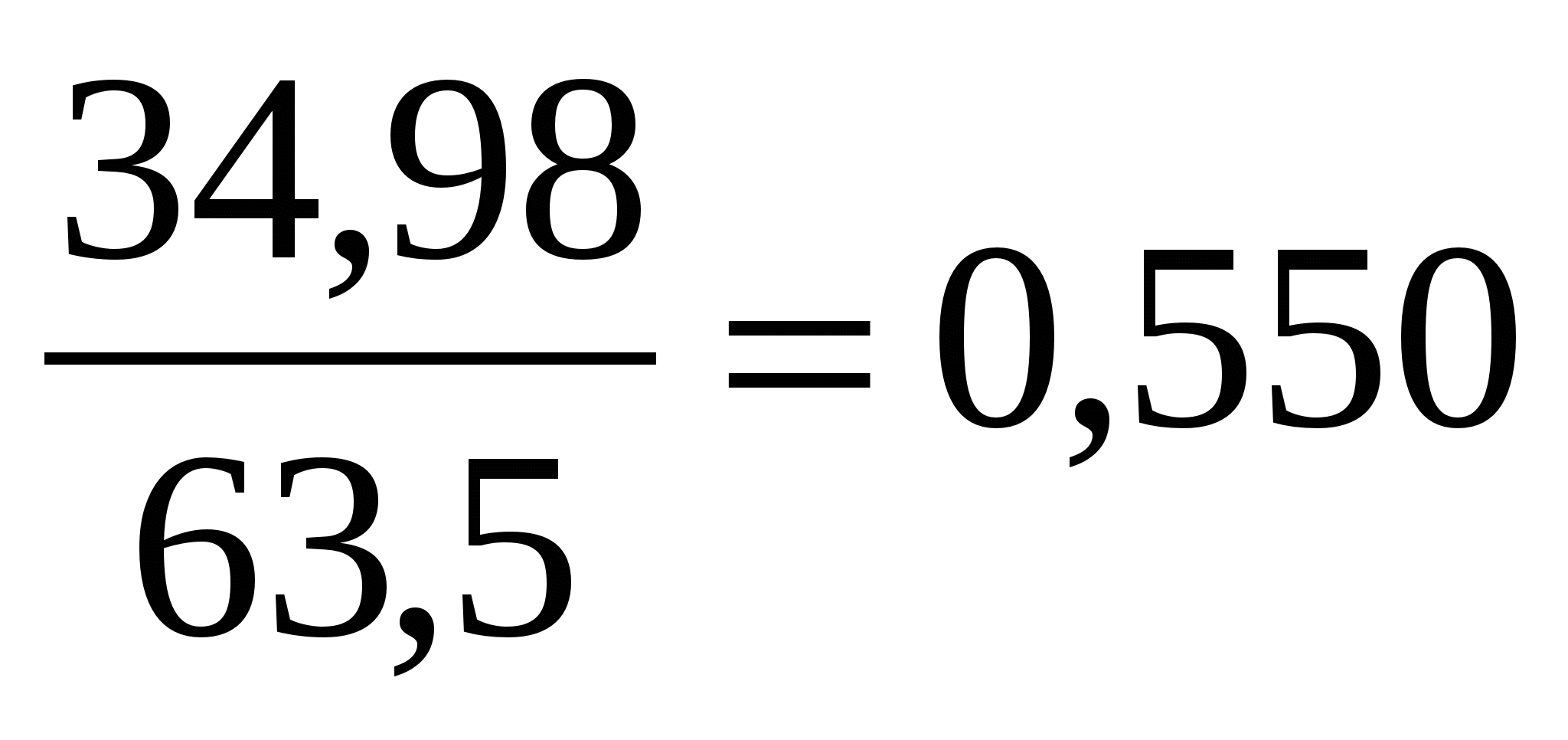 | 1 |
|
| اس | 35,75 |  | 2 |
فرمول کالکوپیریت ترکیب کمی آن را بیان می کند، اما ایده ای از ترکیبات و روش های اتصال بین عناصر ارائه نمی دهد. ضرایب در فرمول شیمیایی فقط رابطه بین عناصر تشکیل دهنده این کانی را نشان می دهد.
در کنار فرمولهای شیمیایی تجربی، از فرمولهای ساختاری نیز استفاده میشود که نه تنها از ترکیب شیمیایی، بلکه از موقعیت مکانی نیز ایده میگیرد.
اتم های یک کانی و پیوند آنها با یکدیگر. به عنوان مثال، فرمول تجربی مالاکیت معدنی H 2 Cu 2 CO 5 است و فرمول ساختاری که در صفحه نشان داده شده است:
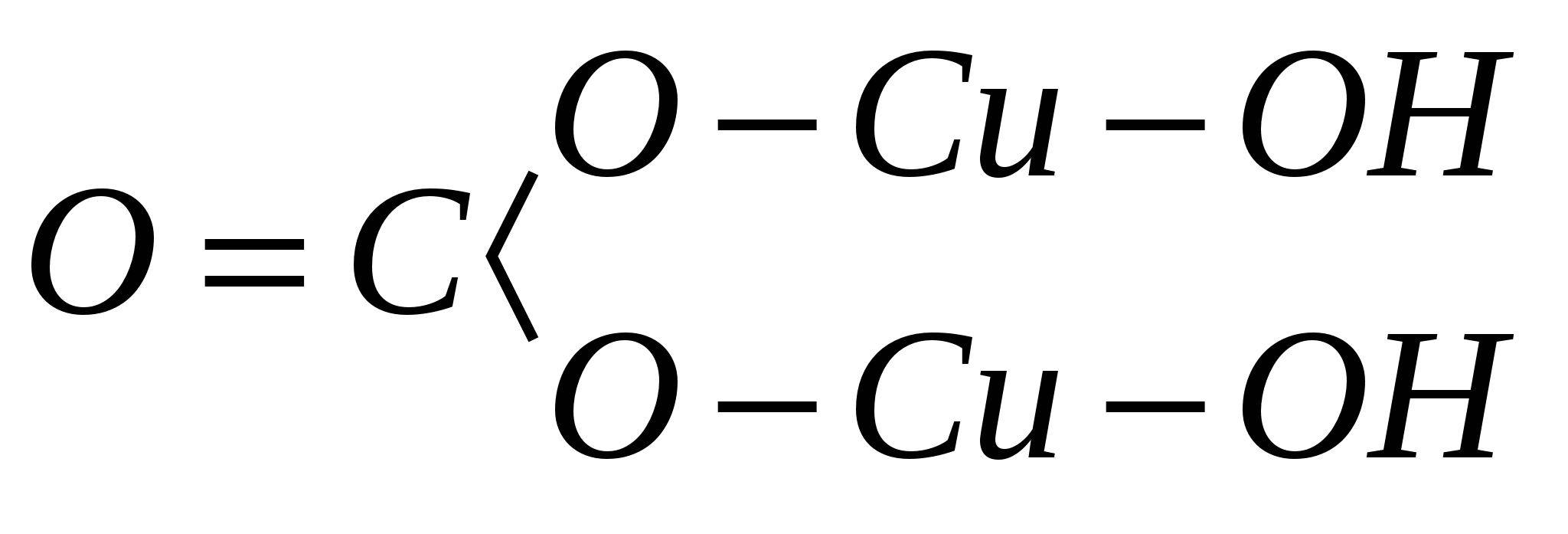
با توجه به موارد فوق، فرمول فوق برای کانی مالاکیت را می توان به شکل زیر نوشت: Cu 2 (OH) 2 CO 3. از این فرمول بر اساس اصل ساختاری، نتیجه می شود که آب به صورت محکم به مس متصل نیست، نه به شکل H 2 O، بلکه به شکل هیدروکسیل (OH) 1-.
روش اشعه ایکس امکان آشکارسازی پیوندهای بین اتمها در ساختارهای کریستالی کانیها و گاهی اوقات مکان اتمها در فضا را ممکن میسازد. علم شیمی کریستال به ارتباط بین شیمی و ساختار یک ماده و خواص آن می پردازد.
در حال حاضر روش های زیادی برای نوشتن فرمول های شیمیایی کانی ها وجود دارد، بسته به اینکه دقیقاً چه چیزی را می خواهند با فرمول منتقل کنند. به عنوان مثال، فرمول ساختاری ارتوکلاز K[(AlSi 3)O 8 ] نوع ترکیب شیمیایی و پیوندهای متقابل بین عناصر منفرد را مشخص می کند. برای انعکاس ترکیب کیفی مهم ترین اجزا (عناصر) و نسبت های کمی آنها، فرمول ارتوکلاز باید به شکل اکسیدهای K 2 O A1 2 O 3 -6Si0 2 ارائه شود.
ترکیب شیمیایی اکثر کانی ها را نمی توان به طور دقیق با یک فرمول بیان کرد. این به ناخالصی های مکانیکی مختلف در کانی ها و توانایی برخی از ترکیبات برای تشکیل مخلوط های ایزومورف یا محلول های جامد بستگی دارد.
ناخالصی ها می توانند مکانیکی، درشت، به راحتی جدا شوند یا بسیار ریز و با سختی زیاد جدا شوند. ظهور ناخالصی ها به دلیل جذب مواد خارجی توسط کانی در حال رشد رخ می دهد. وجود ناخالصی های درشت معمولی بر فرمول ماده معدنی تأثیر نمی گذارد.
ایزومورفیسم (از یونانی "isos" - برابر و "morphe" - شکل) توانایی موادی است که از نظر ترکیب شیمیایی و خواص کریستالوگرافی مشابه هستند برای ایجاد کریستال های مخلوط، یعنی. در طول تبلور از مذاب ها یا محلول ها، یک شبکه کریستالی مشترک بسازید. چنین بلورهایی را مخلوط های ایزومورف می نامند. آنها ترکیب متغیری دارند. در غیر این صورت محلول های جامد نامیده می شوند.
از نظر شیمی و ساختار شبکه کریستالی، دو نوع اصلی هم ریختی متمایز می شود: هم ظرفیتی و دیگری هترووالانت.
با ایزومورفیسم ایزووالانتی، یون های جایگزین متقابل ظرفیت یکسانی دارند، در شبکه کریستالی، ذرات با همان ظرفیت جایگزین می شوند - یک یون با یون دیگر. این ساده ترین حالت تشکیل کریستال های مخلوط است. فرمول های شیمیایی مواد ایزومورف در این مورد کاملاً مشابه است و فقط در یک یون متفاوت است ، معمولاً یک کاتیون ، به عنوان مثال در الیوین ها. الیوین هایی که در سیستم لوزی متبلور می شوند مخلوطی هم شکل از دو ماده هستند: فوستریت Mg 2 و فایالیت Fe 2 که به صورت کانی های مستقل (همچنین سیستم لوزی) نیز وجود دارند. فرمول الیوین: (Mg, Fe) 2 است. کاما بین یون های Mg 2 + و Fe 2 + در این فرمول به این معنی است که آنها می توانند به هر مقدار جایگزین یکدیگر شوند و مجموعه ای پیوسته از ترکیبات با ترکیب میانی را تشکیل دهند. عنصر غالب معمولاً در ابتدا قرار می گیرد.
ایزومورفیسم ناهمگن پیچیده تر است: در شبکه کریستالی، یون های با ظرفیت های مختلف جایگزین می شوند، اما تعادل الکترواستاتیک بازیابی می شود به طوری که مجموع ظرفیت های جفت های جایگزین برابر است. یک نمونه کلاسیک از چنین جایگزینی پیچیده، مواد معدنی از گروه فلدسپات - پلاژیوکلازها است. پلاژیوکلازها یک سری ایزومورفیک پیوسته از مواد معدنی هستند که در یک سیستم تری کلینیک متبلور می شوند، جایی که یک جفت یون Ca 2 + A1 3 + با یک جفت Na + Si 4 + جایگزین می شود. اعضای افراطی این سری - آنورتیت Ca [(A1 2 Si 2)O 8] و آلبیت Na [(A151 3)O 8] - نیز به عنوان کانی مستقل وجود دارند. در این مورد، ظرفیت کل گروه های جایگزین (5 و 5) یکسان است. وقتی NaSi از فرمول آلبیت و CaA1 از فرمول آنورتیت کم شود، باقیمانده برای هر دو فرمول یکسان است - AlSi 2 O 8 .
مطابق با تغییر ترکیب، خواص فیزیکی مواد هم شکل نیز تغییر می کند. به عنوان مثال، خواص نوری پلاژیوکلازها تغییر می کند که اساس تشخیص آنها در طول مطالعه کریستال نوری است. در الیوین ها رنگ کانی از سبز به سیاه تغییر می کند و با افزایش محتوای فایالیت نقطه ذوب کاهش می یابد.
با توجه به درجه کمال جانشینی های هم شکل، دو حالت قابل تشخیص است. در حالت اول، جایگزینی یک عنصر با عنصر دیگر می تواند تا 100٪ باشد - این ایزومورفیسم کامل یا کامل است (الیوین ها، پلاژیوکلازها). در مورد دوم، جایگزینی می تواند جزئی باشد - از صدم تا چند درصد. این یک ایزومورفیسم ناقص یا محدود است. بنابراین، کلسیت Ca [CO 3 ] و منیزیت Mg [CO 3 ] تنها یک ترکیب از ترکیب میانی را ایجاد می کنند - دولومیت CaMg [CO 3] 2. عدم وجود کاما بین کلسیم و منیزیم در فرمول دولومیت نشان می دهد که در اینجا ما یک ترکیب شیمیایی با یک ترکیب خاص داریم و نه یک مخلوط ایزومورف.
عناصری که می توانند در گره های شبکه کریستالی جایگزین یکدیگر شوند (موقعیت یکسانی را در آن اشغال کنند) بدون اینکه ساختار آن نقض شود، با یکدیگر هم شکل نامیده می شوند و متعلق به یک سری هم شکل هستند. مفهوم مجموعه ایزومورفیک عناصر مرتبط با سیستم تناوبی مندلیف توسط آکادمیک V.I. Vernadsky توسعه داده شد. در پوسته های مختلف ترمودینامیکی پوسته زمین، این سری های هم شکل متفاوت هستند، به عنوان مثال. تحت تأثیر دما و فشار تغییر می کند. پس چرا اتمها یا یونهای یک عنصر معین میتوانند جایگزین اتمها (یونهای) فقط برخی و نه همه عناصر در شبکه بلوری شوند؟ برای درک این موضوع، سعی کنید شبکه کریستالی را نه به عنوان سیستمی از نقاط که با شکافهای خالی بزرگ از هم جدا شدهاند (همانطور که معمولاً یک شبکه فضایی به تصویر کشیده میشود)، بلکه به عنوان سیستمی از توپهای لمسی تصور کنید. هر توپ، حوزه عمل یک اتم (یون) است، یعنی فضایی که مطابق با قوانین برهمکنش بارهای الکتریکی، سایر اتم ها (یون ها) که توسط کره های اتمی (یونی) آنها احاطه شده اند، نمی توانند در آن نفوذ کنند.
بنابراین، فواصل بین اتم های خاص (یون) شبکه تحت شرایط خاص دما و فشار کاملاً ثابت است و توسط قوانین الکترواستاتیک تعیین می شود. شعاع حوزه های عمل اتم ها (یون ها) که شعاع اتمی (یونی) نامیده می شود نیز ثابت است. (آر من ) 1 .
اندازه گیری شعاع اتمی و یونی نشان داد که فقط آن دسته از عناصری که شعاع اتمی (یونی) آنها نزدیک به یکدیگر باشد با یکدیگر هم شکل هستند. تفاوت در اندازه شعاع یون های جایگزین متقابل نباید از 15٪ شعاع یون های کوچکتر تجاوز کند.
اجازه دهید آنچه را که گفته شد با مثال توضیح دهیم. یک سری ایزومورف پیوسته برای کربنات های منیزیت Mg [CO 3 ] و Siderite Fe [C0 3 ] به دلیل نزدیکی شعاع اتمی (یونی) منیزیم و آهن آهن شناخته شده است: آر من Mg 2+ =0.74Å; آر من Re 2+ =0.80Å. اعضای این سری را می توان با فرمول (Mg, Fe) [CO 3 ] یا (Fe, Mg) [CO 3] بیان کرد. در اینجا کاما نشان می دهد که یون های Mg و Fe مانند اتم های یک عنصر عمل می کنند. اما برای هالیت NaCl و سیلویت KS1 که در همگامی مکعبی متبلور می شوند، با تشبیه ترکیب شیمیایی، روابط هم شکل (در دمای معمولی) مشاهده نمی شود، زیرا اندازه شعاع یونی آنها بسیار متفاوت است ( آر من Ma + = 0.98 Å، و آر من K + = 1.33 Å).
پدیده جانشینی های ایزومورف تحت شرایط مختلف خارجی بدون تغییر باقی نمی ماند. در دماهای بالا، جانشینی راحتتر انجام میشود و بسیاری از موادی که در دماهای معمولی هم شکل نیستند، در دماهای بالا هم شکل میشوند. به عنوان مثال، قلیایی فلدسپات هاارتوکلازهای K [(А1Si 3)О 8 ] و آلبیت Na [(А1Si 3) О 8 ] پس از تبلور از ماگما یک سری هم شکل پیوسته (К, Na) [(А1Si 3) 0 8 ] تشکیل می دهند، اما پس از آن، به عنوان دما کاهش می یابد، این مخلوط ایزومورف دوباره در حالت جامد به دو کانی مستقل تجزیه می شود: یکی با محتوای غالب پتاسیم - ارتوکلاز و دیگری با محتوای غالب سدیم - آلبیت. این پدیده را تجزیه محلول های جامد می نامند.
1 شعاع یونی (اتمی) با آنگستروم (Å) اندازه گیری می شود. 1 Å = 10-8 سانتی متر.
اکثر کانی ها حاوی ناخالصی های هم شکل در مقادیر مختلف هستند. مهم ترین و رایج ترین گروه سیلیکات ها (الیوین، پیروکسن ها، آمفیبول ها، فلدسپات ها) مخلوط های ایزومورف هستند.
ایزومورفیسم به درک علل تداعیهای متعدد عناصر در پوسته زمین کمک میکند و پیشبینی وجود برخی عناصر کمیاب (پراکنده) تجاری خاص در بسیاری از کانیهای گسترده را ممکن میسازد. بنابراین، به عنوان مثال، ژرمانیوم توسط سیلیکون، سزیم، روبیدیم - توسط پتاسیم و غیره پوشانده می شود.
چندشکلی (از یونانی "poly" - many و "morphe" - شکل) یا چند شکلی، توانایی یک ماده برای متبلور شدن با ترکیب شیمیایی یکسان در ساختارهای مختلف مربوط به انواع مختلفتقارن یا همزمانی انواع جداگانه یک ماده، با ساختار متفاوت، در خواص آنها متفاوت است. آنها مواد معدنی هستند - انواع چندشکلی (اصلاحات) یک ماده معین. وقوع چنین مواردی با شرایط مختلف فیزیکوشیمیایی تشکیل آنها (دما، فشار) و ماهیت محیط توضیح داده می شود. انواع چند شکلی از یک ترکیب شیمیایی نامهای متفاوتی دارند یا با حروف الفبای یونانی α، β، γ نشان داده میشوند.
نمونه کلاسیک پلی مورفیسم کربن است. در دو سیستم متبلور می شود: مکعب - الماس و شش ضلعی - گرافیت. خواص این دو کانی با یکدیگر بسیار متفاوت است. الماس به دلیل سختی بالا قابل توجه است، سخت ترین مواد معدنی شناخته شده برای ما است، الکتریسیته را هدایت نمی کند. کریستال های بی رنگ و شفاف آن درخشش غیرعادی قوی ای دارند.
گرافیت خواص کاملا متفاوتی دارد. سختی آن کوچک است (مدادهای گرافیت)، به راحتی به پوسته تقسیم می شود، به خوبی هدایت می شود برق. سنگدانه های گرافیت با تیرگی و رنگ خاکستری سیاه یا استیل متمایز می شوند.
چگالی آنها نیز به شدت متفاوت است: الماس دارای چگالی 3.5 - 3.6 است، گرافیت دارای چگالی 2.2 است.
الماس در دمای بالا و بسیار تشکیل می شود فشار بالا، در اعماق زیاد در داخل زمین، گرافیت - در عمق کمتر، در دما و فشار کمتر.
دلیل خواص متفاوت الماس و گرافیت به دلیل ساختار آنهاست. آرایش اتم های کربن در گرافیت، پیوند اتمهای کربن نسبت به الماس قویتر است. ساختار گرافیت با آرایش متراکم اتم های کربن در صفحات موازی مشخص می شود (شکل 25). در هر لایه، اتم ها در گوشه های شش ضلعی منظم قرار دارند و پیوند قوی بین آنها وجود دارد. در جهت عمودی، لایه ها با فواصل زیاد از یکدیگر جدا شده و ارتباط بین آنها ضعیف تر است. چند شکلی کانی ها که هستند عناصر شیمیایی(کربن، گوگرد و غیره) آلوتروپی نامیده می شود. تغییرات شش ضلعی، لوزی و مونوکلینیک گوگرد به خوبی شناخته شده است.
سازندهای پیچیده تری نیز به شکل انواع مختلف چندشکلی یافت می شوند: CaCO 3، FeS 2 و غیره.
انتقال یک گونه چندشکلی (اصلاح) به دیگری، به عنوان مثال، به دلیل تغییر دما، به طور ناگهانی رخ می دهد، با تغییر ساختار ساختار در یک ویژگی خاص از این تنوع (در صورتی که فشار بدون تغییر باقی بماند) و همراه با انتشار یا جذب گرما
پلی فرمیسم سیلیس (SiO 2) به خوبی مورد مطالعه قرار گرفته است که سه نوع اصلی را تشکیل می دهد: کوارتز، تری دیمیت و کریستوبالیت، که هر کدام دارای چندین اصلاح هستند. با افزایش دما، کوارتز که فقط تا 573 درجه سانتیگراد پایدار است، به طور متوالی به تعدادی از تغییرات چند شکلی تبدیل می شود:
آگاهی از دماهای تبدیل های چندشکلی کوارتز برای اهداف عملی استفاده می شود (به عنوان مثال، برای به دست آوردن تری دیمیت، یک ماده نسوز که در محدوده دمایی 870-1470 درجه سانتیگراد تغییر شکل نمی دهد، کوارتز تا دمای بالای 870 درجه از قبل گرم می شود. ج).
وجود تغییرات چندشکلی در سیلیس امکان استفاده از آن را به عنوان "دما سنج" زمین شناسی فراهم می کند. با یافتن یک یا آن اصلاح چند شکلی در میان سنگ هاو رسوبات رگهای، میتوانیم فواصل دمایی را که در آن تشکیل سنگ اتفاق افتاده است قضاوت کنیم.
برای تشکیل انواع چند شکلی از یک ماده، فواصل معینی از دما و فشار لازم است. با تغییر در این پارامترها، ناپایدار می شود و از نظر تئوری با گذشت زمان باید به گونه ای تبدیل شود که در شرایط جدید پایدار باشد. اما به دلیل سرعت بسیار پایین بازآرایی شبکه کریستالی در دماهای پایین، انواع چندشکلی یک ماده می توانند در شرایط یکسان برای مدت تقریباً بی نهایت طولانی وجود داشته باشند: یکی در حالت پایدار و دیگری در حالت نسبتاً ناپایدار (برای به عنوان مثال، الماس در سطح زمین).
قبلاً در بالا ذکر کردیم که اکثریت قریب به اتفاق مواد معدنی طبیعی ترکیبات شیمیایی هستند. از جمله موارد اخیر عبارتند از:
- آ) مسلم - قطعیاتصالات تک و دوتایی و
- ب) اتصالات ترکیب متغیر.
همچنین به طور گسترده استفاده می شود محلول های جامد، یا به اصطلاح مخلوط های ایزومورفیک. شبه محلول های جامد باید از این محلول های جامد واقعی متمایز شوند، همانطور که این تمایز در محلول های مایع انجام می شود.
در نهایت باید توجه ویژه ای داشت ترکیبات آب، ایده هایی که در سال های اخیر در مورد آنها به طور قابل توجهی اصلاح شده است.
ترکیبات خاص. همه ترکیبات شیمیایی خاص، همانطور که مشخص است، به شدت از قانون ثبات ترکیب، که با فرمول های شیمیایی، قانون نسبت های چندگانه و قانون سهام بیان می شود، پیروی می کنند، که نسبت اجزای یک ترکیب معین را با نسبت های آنها در سایر ترکیبات مرتبط می کند. انواع ترکیبات این قوانین مطابق با سیستم تناوبی عناصر D.I. مندلیف، قوانین شیمی کریستال و دکترین تقارن در محیط های کریستالی است.
مشخصه این است که این ترکیبات با تعدادی خواص فیزیکی خاص متمایز می شوند که به وضوح در نمودارهای فیزیکوشیمیایی نقطه ذوب، حلالیت، هدایت الکتریکی، سختی، وزن مخصوص، ضریب شکست و غیره
برخی از ترکیبات شیمیایی عبارتند از:
- اکسیدها (Cu 2 O، MgO، Fe 2 O 3، SiO 2، و غیره)،
- نمک های مختلف اکسیژن (CaCO 3، CaSO 4، AlBO 3، Mg 2 SiO 4 و غیره)،
- سولفیدها (NiS، FeS 2، Sb 2 S 3، و غیره)،
- ترکیبات هالوژن (NaCl، AgBr، CaF 2، و غیره) و غیره.
ترکیب شیمیایی ترکیبات شیمیایی را می توان به دو صورت نشان داد:
- در قالب فرمول های تجربی و
- در قالب فرمول های اساسی یا ساختاری.
فرمول های تجربی ترکیب کانی ها را یا به شکل عناصر موجود در ترکیب بیان می کنند (به عنوان مثال، BaSO 4، Na 3 AlF 6، NaAlSi 3 O 8، و غیره)، یا به شکل تعدادی از ساده ترین ترکیبات تشکیل دهنده. BaO SO 3، 3NaF AlF 3، Na 2 O Al 2 O 3 6SiO 2 و غیره). نوع دوم فرمول ها، اگرچه با ایده های مدرن در مورد ماهیت ترکیبات شیمیایی مطابقت ندارد، اما دارای این مزیت است که یادآوری ترکیب مواد معدنی را آسان تر می کند.
اصلاحات قابل توجهی در طرح کلی فرمول های ترکیبات پیچیده تر توسط داده های شیمی کریستال بر اساس مطالعه پراش اشعه ایکس کانی ها انجام شده است. از آنجایی که بیشتر مواد کریستالی معدنی با پیوندهای یونی واحدهای ساختاری مشخص میشوند، مهم است که این عناصر ساختاری (یونها و کمپلکسها) که در انواع مختلف ساختارهای کریستالی ایجاد شدهاند در فرمولهای ترکیبات شیمیایی منعکس شوند. کمپلکس های آنیونی در این مورد معمولاً با براکت های مربع از کاتیون ها جدا می شوند، به عنوان مثال، Mg 2، Ca 3 2، Mg 2، Na و غیره.
اتصالات دوگانه. علاوه بر ترکیبات شیمیایی ساده، ترکیبات مضاعف در طبیعت رایج است، به ویژه نمک های مضاعف. نمک های مضاعف ترکیبات خاصی هستند که از دو نمک ساده در نسبت های متعدد تشکیل شده اند. در بیشتر موارد، این نمک ها در کاتیون ها دو برابر هستند، کمتر در آنیون ها یا به طور همزمان در کاتیون ها و آنیون ها. موارد زیر را می توان به عنوان مثال آورد: CaMg 2، K 3 Na 2، و غیره.
هنگام مقایسه فرمول های نمک های مضاعف، معلوم می شود که کاتیون های موجود در ترکیب آنها، به دلیل تفاوت قابل توجه در شعاع یونی آنها، نمی توانند به طور ایزومورفیک جایگزین یکدیگر شوند: Ca 2 + (1.01، Å) و Mg 2 + (0.75 Å). K 1 + (1.33Å) و Na 1+ (0.98Å)، و غیره. بنابراین، تعجب آور نیست که آنها با نمک های ساده تشکیل دهنده خود در برخی ویژگی های ساختارهای بلوری و اغلب خواص فیزیکی متفاوت هستند.
ترکیبات با ترکیب متغیر. علاوه بر برخی از ترکیبات شیمیایی، تعداد کمی از این ترکیبات وجود دارد که ترکیب آنها ثابت نیست، اما در محدوده های باریک یا گسترده تر در نوسان است و این نوسانات در ترکیب را نمی توان با هیچ ناخالصی مکانیکی مواد خارجی توضیح داد. برعکس، ترکیب نوسان ترکیبات از دیدگاه شیمیایی کریستالی توضیحی در حلالیت محدود اجزای تشکیل دهنده در یک ترکیب معین می یابد. چنین تشکیلات شیمیایی را ترکیبات با ترکیب متغیر می نامند.
در بین کانی ها، ترکیبات با ترکیب متغیر بسیار زیاد است. در میان آنها، قبل از هر چیز، باید به نمک های دوگانه ای اشاره کرد که در آنها نمک های ساده آنها، اگرچه دارای شبکه های کریستالی مشابه هستند، به دلیل تفاوت قابل توجه در اندازه شعاع های یونی یا به دلیل تفاوت در خواص قطبش، ایزومورفیسم کامل را نشان نمی دهند. . بنابراین، آنها با یک نوسان جزئی از ترکیب مشخص می شوند که در مطابقت نادرست با فرمول های شیمیایی آن با نسبت های کاملاً استوکیومتری اجزا بیان می شود.
در مقادیر کم، ناخالصی های ایزومورف سایر اجزاء در بسیاری از ترکیبات ساده و پیچیده یافت می شوند. به عنوان مثال، اسفالریت (ZnS) که در آن محتوای آهن به شکل یک ناخالصی ایزومورفیک به چند درصد می رسد، از جمله این موارد است. مثال های متعدد دیگری در توضیح کانی ها آورده خواهد شد.
ترکیبات شیمیایی با ترکیب متغیر از نظر خواص با محلول های جامد تفاوتی ندارند و باید به این صورت در نظر گرفته شوند، اما با اختلاط محدود اجزاء.
محلول های جامد. توانایی مواد کریستالی با ترکیبات مختلف برای تشکیل مخلوط هایی از یک ساختار بلوری، که به طور مداوم در ترکیب تغییر می کند، تا حد زیادی بر اساس ایزومورفیسم است، یعنی ویژگی عناصر برای جایگزینی یکدیگر در ترکیبات شیمیایی یک ترکیب مرتبط.
ایزومورفیسم دو ماده زمانی اتفاق میافتد که فرمول شیمیایی مشابهی داشته باشند و بارهای یونهای متناظر هر دو ماده از نظر علامت یکسان باشند و اندازه یونها و درجه قطبش آنها از حد شناخته شده فراتر نرود، یعنی: آنها با درجه خاصی از دقت برابر هستند.
AT شرایط طبیعیبه عنوان مثال، گسترده است یکنواختایزومورفیسم Mg 2+ (شعاع یونی 0.75A) با یون های دو ظرفیتی Fe 2+ (0.79Å)، Ni 2+ (0.74Å)، Co 2+ (0.77Å)، روی 2+ (0.79Å) و Mn 2 + (0.91Å). مثال دیگر ایزومورفیسم یون های سه ظرفیتی است: Fe 3+ (0.67Å)، Cr 3+ (0.64Å) Al 3+ (0.57Å)، Mn 3+ (0.70Å)، V 3+ (0.65Å)، Ti 3 + (0.69Å). همین امر در مورد واحدهای ساختاری پیچیده درگیر در ساختار شبکه های کریستالی، به عنوان مثال، 2-، 2- و غیره صدق می کند.
با این حال، همراه با این، به طور تجربی ثابت و تأیید شده است که در طول تشکیل کانیهایی با ترکیب متغیر در ساختارهای کریستالی، نه تنها یونها (یا اتمهای) ساده را میتوان با یونهای (یا اتمهای) دیگر هموالان جایگزین کرد، بلکه کل آن را نیز میتوان جایگزین کرد. گروه هایی از یون ها را می توان با گروه هایی از یون های دیگر با ظرفیت متفاوت، اما با مجموع یکسانی از همه ظرفیت ها جایگزین کرد. این مورد نام دارد هترو ظرفیتیایزومورفیسم به عنوان مثال، ایزومورفیسم در سری پلاژیوکلازها، که در آن گروه NaAlSi 3 O 8 در نسبت های بسیار متفاوت می تواند با گروه CaAl 2 Si 2 O 8 با تشکیل کریستال هایی با کلاس تقارن یکسان جایگزین شود. در اصل، در اینجا ما جایگزینی Na 1 + Si 4 + با Ca 2 + Al 3 + را داریم.
در ایزومورفیسم هترو ظرفیتی، اندازه واحدهای ساختاری که جایگزین یکدیگر می شوند (اتم ها، یون ها، مجتمع های یونی) هنوز نقش تعیین کننده ای دارند: آنها باید کم و بیش یکسان باشند. تفاوت در شعاع اجزایی که جایگزین یکدیگر می شوند، همانطور که مقایسه ها نشان می دهد، معمولاً از 15٪ شعاع کوچکتر تجاوز نمی کند.
همانطور که می دانیم، شعاع یونی در گروه های عمودی سیستم تناوبی عناصر با افزایش شماره سریال افزایش می یابد و با افزایش تعداد گروه (یعنی با افزایش ظرفیت) در جهت افقی کاهش می یابد. بر این اساس، A. E. Fersman قانون ردیف های مورب یون های هم شکل در سیستم تناوبی عناصر را استخراج کرد که برای سمت چپ آن معتبر است. سری های ایزومورفیسم یون ناهمگن زیر مشخص شده اند (شعاع یونی در آنگستروم در پرانتز نشان داده شده است):
- Li 1+ (0.69) -Mg 2+ (0.75) -Sc 3+ (0.81) -Zr 4+ (0.82)
- Na 1+ (0.98) -Ca 2+ (1.01) -Y 3+ (1.06)
- K 1+ (1.33) -Sp 2+ (1.27)
- Rb 1+ (1.48)-Ba 2+ (1.36)
- Al 3+ (0.57) -Ti 4+ (0.65) -Nb 5+ (0.70)
در واقع، در ترکیبات طبیعی، ما اغلب مشاهده می کنیم که به عنوان مثال، کانی های لیتیوم حاوی ناخالصی های منیزیم ایزومورف، مواد معدنی منیزیم - ناخالصی های اسکاندیم، مواد معدنی سدیم - ناخالصی های کلسیم، مواد معدنی کلسیم - ناخالصی های ایتریم و غیره هستند.
علاوه بر این، در آنیون های پیچیده، یون 4- را می توان با یون های 5-، 3- و 2- جایگزین کرد که اندازه های یکسان یا مشابه دارند. در مورد نمونه هایی از آنچه گفته شد، ما بیش از یک بار هنگام توصیف مواد معدنی متوقف خواهیم شد.
از نقطه نظر ژنتیک، تمایز بین دو نوع محلول جامد مهم است:
- محلول های جامد واقعی و
- محلول های شبه جامد
محلول های جامد واقعی، یا همانطور که نام دیگر آنها مخلوط های ایزومورف * ، مخلوط هایی هستند که از نظر ساختار بلوری کاملاً همگن به هر نسبتی از دو یا چند ماده هستند که ترکیبات شیمیایی را تشکیل نمی دهند. به عنوان مثال می توان از محلول های جامد طلا و نقره، تنگستات های منگنز و آهن، پلاژیوکلازها و غیره نام برد.
* (در ادبیات، مترادفی برای "کریستال های مخلوط" نیز وجود دارد (به معنای واقعی کلمه از زبان آلمانی). عنوان کاملا درست نیست.)
خواص فیزیکی و شیمیایی محلول های جامد افزودنی است، یعنی به تدریج و به طور منظم با افزایش محتوای جزء دوم تغییر می کنند. اینها به عنوان مثال، تغییر در نقطه ذوب، وزن مخصوص، ضریب شکست، انعکاس، هدایت الکتریکی و غیره هستند. تغییرات در تمام این ویژگی ها در نمودارها به صورت خطوط مستقیم (برای وزن مخصوص) یا منحنی های منحنی صاف بیان می شوند. (نقاط ذوب، خواص نوری و غیره). این منحنی ها برای سری های هم شکل به قدری مشخص هستند که با توجه به مجموع ویژگی های مورد مطالعه هر نوع معدنیمی توان از آنها برای تعیین ترکیب آن بدون استفاده از تجزیه و تحلیل شیمیایی استفاده کرد. به عنوان مثال، تعیین ترکیب پلاژیوکلاز به این روش با استفاده از نمودارهای خاص با مطالعه خواص نوری آن در مقاطع نازک زیر میکروسکوپ کار دشواری نیست.
* ("افزودن" - اضافه کنید)
دو نوع محلول جامد واقعی وجود دارد:
- الف) محلول های جامد جایگزین (یا محلول های نوع اول) و
- ب) محلول های جامد بینابینی (یا محلول های نوع دوم).
الف) محلول های جامد جانشین مخصوصاً مشخصه فلزات و ترکیبات یونی هستند. ماهیت آنها در این واقعیت خلاصه می شود که در ترکیباتی با شبکه های کریستالی مشابه ساخته شده، اتم ها یا یون های یک ترکیب با ترکیبات دیگری جایگزین می شوند (یعنی جای سایرین را می گیرند). اینها، به عنوان مثال، سری های ایزومورف هستند: ZnCO 3 -FeCO 3، MnWO 4 -FeWO 4 و غیره.
ب) محلول های جامد بینابینی با این واقعیت مشخص می شوند که جزء دوم فقط در حفره ها قرار دارد، یعنی در شکاف های بین اتم ها یا یون هایی که شبکه بلوری جزء اول را تشکیل می دهند. این نوع محلول جامد تنها در شرایطی می تواند انجام شود که اندازه اتم ها (یون ها) هر دو جزء به شدت با یکدیگر متفاوت باشند. بارزترین نمونه از این نوع محلول جامد، محلول کربن در آهن است که به آسانی در دماهای بالا تشکیل می شود و با سرد شدن آهسته به آهن و کاربید آهن (Fe 3 C) تجزیه می شود.
در فرمولهای شیمیایی محلولهای جامد، اتمها یا یونهای هممورف در داخل پرانتز قرار میگیرند، با کاما از یکدیگر جدا میشوند و به ترتیب نزولی محتوا مرتب میشوند: (Au، Ag)، (Zn، Fe) S، (Zn، Fe)CO. 3، (Fe،Mn)WO 4، و غیره. ناخالصی های ایزومورف جزئی یا اصلاً در فرمول مشخص نشده اند یا با چاپ کوچکتر وارد می شوند. اگر یکی از اجزای یک نمک مضاعف حاوی ناخالصی های ایزومورف باشد، فرمول به صورت زیر نمایش داده می شود: Ca(Mg,Fe)2.
شبه راه حل های جامدآنها با موارد واقعی متفاوت هستند زیرا حاوی ناخالصی های ریز پراکنده از مواد خارجی هستند که وجود آنها را نمی توان بر اساس قوانین شیمی کریستال توضیح داد. نمونههایی از شبه محلولهای جامد، نمکهای کریستالی هستند (ص. 39)، بهویژه، کانیهای شفاف رنگی مانند رز کوارتز، کلسیت قرمز، اسفالریت سیاه و غیره، که به نظر میرسد کاملاً همگن هستند (رنگدانه رنگآمیزی بسیار ریز در آنها).
اتصالات آب. ابتدا باید نکته مهم زیر را بیان کنیم. ترکیبات آبی باید فقط شامل ترکیباتی باشند که دارای ترکیبات الکتریکی خنثی در ترکیب خود باشند. مولکول های آب. پیش از این، تحت پوشش ترکیبات آب، مواد معدنی حاوی آنیون های هیدروکسیل [OH] 1- نیز در نظر گرفته می شد. با این حال، بین مولکول H 2 O و یون [OH] 1- دارای بار منفی، البته یک تفاوت اساسی وجود دارد که تأثیر بسیار مهمی بر فیزیکی و خواص شیمیاییمواد معدنی هیدروکسیل، به عنوان یک یون، قادر به جایگزینی آنیون هایی مانند F 1-، Cl 1- در ترکیبات است و در شبکه های کریستالی محکم نگه داشته می شود. مولکول H 2 O این خاصیت را ندارد و به دلیل اتصال ضعیف در شبکه، هنگام گرم شدن به راحتی حذف می شود. این واقعیت که هیدروکسیل پس از کلسینه کردن مواد معدنی حاوی آن و خروج از شبکه کریستالی، می تواند به بخار آب تبدیل شود، به هیچ وجه نمی تواند مبنایی برای شناسایی آن با مولکول H 2 O باشد. بنابراین، بسیار مهم است که به طور جداگانه وجود هیدروکسیل و آب در فرمول های شیمیایی کانی ها را نشان می دهد. از این دیدگاه، به عنوان مثال، مالاکیت - Cu 2 2 آب نیست، بلکه کربنات مس بی آب اصلی است، اگرچه در تجزیه و تحلیل شیمیایی، هیدروکسیل به شکل H 2 O تعیین می شود. همین امر در مورد مواد معدنی که نمک های اسیدی هستند نیز صدق می کند. ، که در بین کاتیون ها هیدروژن وجود دارد.
بسته به نحوه نگهداری آب در مواد معدنی، موارد زیر وجود دارد:
- تبلور یا آب مقیدشامل شبکه های کریستالی مواد معدنی و
- آب آزاد، که در ساختار خود ماده کریستالی دخالتی ندارد
آب مقیددر شبکه به شکل مولکول های H 2 O شرکت می کند و مکان های کاملاً مشخصی را در آن اشغال می کند. تعداد مولکول های آب به نسبت ساده به سایر اجزای ترکیب است. نمونه های زیر عبارتند از: Na 2 CO 3 10H 2 O (سودا)، CaSO 4 2H 2 O (گچ)، Ni 3 2 8H 2 O (آنابرگیت)، Al 2 3 5H 2 O (موج)، و غیره. هیدرات های کریستالی نامیده می شوند که به گفته ورنر باید آنها را به عنوان "ترکیبات پیچیده" در نظر گرفت، یعنی ترکیباتی که در آنها مولکول های آب به عنوان واحدهای ساختاری با هماهنگی خاصی در اطراف برخی یون ها قرار گرفته اند و در نتیجه نوعی یون های پیچیده ایجاد می کنند.
بنابراین، در ساختار کریستالی ترکیب NiSO 4 6H 2 O، مطالعات اشعه ایکس نشان داده است که شش مولکول دوقطبی H 2 O مستقیماً کاتیون Ni 2 + را احاطه کرده اند و بدیهی است که خود را به روشی خاص نسبت به کاتیون جهت گیری می کنند (دو پروتون های H 1+ به حاشیه یون کمپلکس) . از آنجایی که مولکول H 2 O خود از نظر الکتریکی خنثی است، کاتیون هیدراته 2+ بار Ni 2+ را حفظ می کند. از همین رو فرمول شیمیاییاتصالات باید به صورت زیر نوشته شوند:
ما بعداً (در مقدمه نمک های اکسیژن) به دلیل هیدراتاسیون یون ها در شبکه های کریستالی خواهیم پرداخت. در اینجا فقط می توانیم به این نکته اشاره کنیم که نیاز به هیدراتاسیون یون ها از نظر کریستالوشیمیایی کاملاً توجیه شده است. برای تشکیل شبکههای بلوری پایدار از آنیونهای با اندازه بزرگ مانند 2-، کاتیونهای Ni 2+ موجود در محلول بسیار کوچک هستند، به همین دلیل است که میل به افزایش حجم آنها بدون تغییر بار وجود دارد. ناگفته نماند که تشکیل هیدرات های کریستالی تنها در محیط های غنی از آب می تواند رخ دهد و در دمای پایین.
هنگامی که هیدرات های کریستالی گرم می شوند، به راحتی آب می شوند، اگر نه به طور یکباره، سپس به طور ناگهانی، به طور دوره ای برخی از مولکول های آب را از دست می دهند. در این حالت، بازآرایی شبکه با حفظ نسبت های منطقی بین تعداد مولکول های H 2 O و ترکیب اصلی رخ می دهد. به عنوان مثال، کالکانتیت (CuSO 4 5H 2 O ) در طول کم آبی مصنوعی ابتدا CuSO 4 3H 2 O ، سپس CuSO 4 H 2 O و در نهایت CuSO 4 تشکیل می دهد. در عین حال خواص فیزیکی مانند ضریب شکست، وزن مخصوص و ... نیز به طور ناگهانی تغییر می کند. ترکیبات مختلفآب در دماهای مختلف حذف می شود: برخی از آنها آن را در دمای اتاق از دست می دهند (سولفات های مس و آهن چند آب)، برخی دیگر در دماهای بالاتر و حتی در دمای بالای 100 درجه.
آب رایگانموجود در توده های معدنی، با این واقعیت مشخص می شود که مستقیماً در ساختار شبکه بلوری مواد معدنی شرکت نمی کند. هنگامی که گرم می شود، به تدریج آزاد می شود. سه نوع آب رایگان وجود دارد:
- الف) زئولیت
- ب) کلوئیدی و
- ج) رطوبت سنجی
آب زئولیت نام خود را از نام عمومی گروه خاصی از مواد معدنی - زئولیت ها گرفته است که در آن ویژگی های حضور آن به وضوح آشکار می شود. مشخص شده است که مولکول های آب در این گروه از مواد معدنی هیچ موقعیت کاملاً مشخصی در شبکه کریستالی اشغال نمی کنند، بلکه فقط در حفره های آزاد در آن (در امتداد کانال ها، در فضاهای بین لایه ای و غیره) قرار دارند. بنابراین، "حلالیت" آب در آنها به طور قابل توجهی محدود است. جالب توجه است که مقدار آب موجود در آنها می تواند بدون نقض همگنی کریستالی ماده با تغییر تدریجی خواص فیزیکی تغییر کند: درجه شفافیت، ضریب شکست، وزن مخصوص و غیره. این نشان می دهد که آب در حالت محلول جامد است. . هنگامی که گرم می شود، در محدوده 80-400 درجه آزاد می شود. جالب است که زئولیتهایی که با حرارت دادن دقیق کم آب میشوند، دوباره قادر به جذب آب با بازیابی خواص فیزیکی قبلی خود هستند.
آب کلوئیدی، همانطور که از نام خود پیداست، در هیدروژل ها گسترده است، جایی که بر روی سطح فازهای پراکنده (ص. 37) توسط نیروهای اتصال بسیار ضعیف نگه داشته می شود. این در اصل آب جذب است و وجود آن به شبکه جاذب بستگی ندارد (البته خود جاذب ممکن است حاوی آب کریستالی متصل به مواد شیمیایی باشد). به عنوان مثال اوپال (هیدروژل سیلیس) - SiO 2 aq (aq دو حرف اول کلمه لاتین "aqua" - آب است). این نامگذاری آب کلوئیدی که توسط برخی نویسندگان پذیرفته شده است، باید منطقی شناخته شود.
آب هیگروسکوپیک (مویرگی) در شکاف های نازک، منافذ و توده های پودری توسط نیروهای کشش سطحی نگه داشته می شود. در بیشتر موارد، هنگامی که تا 100-110 درجه حرارت داده می شود، به راحتی حذف می شود. نمی توان مرز تیز بین آب مویرگی و کلوئیدی ترسیم کرد.
برای تعیین ترکیب شیمیایی کانی، آنالیز شیمیایی آن انجام شده و فرمول شیمیایی کانی مشخص می شود. فرمول ها می توانند تجربی باشند و فقط ترکیب شیمیایی را نشان دهند و ساختاری داشته باشند و ایده ای از آرایش فضایی اتم ها در یک کانی و رابطه آنها با یکدیگر ارائه دهند. برای برخی از مواد معدنی، فرمول ساختاری هنوز ایجاد نشده است. اما به لطف روش های تحقیقاتی اشعه ایکس، در بسیاری از موارد امکان تعیین رابطه اتم ها در ساختارهای بلوری مواد معدنی وجود داشت. این مسائل مربوط به ارتباط شیمی با ساختار ماده و خواص آن توسط شیمی کریستال بررسی می شود.
در کانی ها، شناسایی کاتیون ها و کمپلکس های آنیونی که انواع ساختارهای کریستالی را مشخص می کنند، مهم است. هنگام نوشتن فرمول های معدنی، کمپلکس های آنیونی با براکت های مربعی از کاتیون ها جدا می شوند، به عنوان مثال، سیدریت Fe. باید در نظر داشت که فرمول های تجربی کانی ها ویژگی های ساختار داخلی آنها را منعکس نمی کنند و در کانی شناسی در حال حاضر جایگزین آنها می شود. فرمول های ساختاری. بنابراین، فرمول تجربی مسکویت معدنی H 2 KAl 3 Si 3 O 12 و فرمول ساختاری KAl 2 (OH, F) 2 است. دومی نشان می دهد که یک کمپلکس آنیونی پیچیده در ساختار مسکویت وجود دارد و آب موجود در مسکوویت به شکل H 2 O نیست، بلکه به شکل هیدروکسیل (OH) - است و این هیدروکسیل به نوبه خود می تواند جایگزین شود. F - .
در کانی شناسی، کانی های بی آب و آبی (سولفات ها، فسفات ها، کربنات ها و غیره) اغلب متمایز می شوند. مواد معدنی آب شامل آن دسته از مواد معدنی است که حاوی مولکول های آب خنثی الکتریکی هستند. آب موجود در ترکیب مواد معدنی می تواند محدود و آزاد باشد. آب بسته یا تبلور شده وارد شبکه بلوری مواد معدنی می شود و مکان های خاصی را در آن اشغال می کند. به عنوان مثال می توان به کربنات ها و سولفات های خاص مانند گچ اشاره کرد. آب آزاد در ساختار شبکه کریستالی مواد معدنی شرکت نمی کند، مقدار آن می تواند بسته به دما متفاوت باشد. نمونه هایی از آب آزاد آب زئولیت است. و البته، تمام آب هایگروسکوپی که در شکاف های میکروسکوپی مواد معدنی و سنگ ها توسط نیروهای کشش سطحی نگهداری می شوند، نیز آزاد هستند. با حرارت دادن تا 110 درجه سانتیگراد حذف می شود. مواد معدنی حاوی هیدروکسیل به معنای دقیق آن را نمی توان مواد معدنی آب نامید. یک تفاوت اساسی بین مولکول آب خنثی H 2 O و یون هیدروکسیل با بار منفی (HO) وجود دارد. هیدروکسیل (HO) - می تواند جایگزین یون هایی مانند کلر و آهن در مواد معدنی شود، در شبکه های کریستالی محکم نگه داشته می شود و مولکول های آب این خواص را ندارند.
وظیفه 3.بررسی اشکال دفع طبیعی مواد معدنی.
مورفولوژی مواد معدنی و سنگدانه ها. دوقلوها
رشد متقابل کریستال ها
برای برخی از مواد معدنی (فلدسپات، روتیل، کاسیتریت، آراگونیت، سینابار و بسیاری دیگر)، تشکیل نه تنها تک بلورها، بلکه رشدهای دوقلوی آنها - دوقلوها نیز مشخص است. در اتصالات واقعی و نه تصادفی، افراد در امتداد شبکه های مسطح شبکه های فضایی خود با هم رشد می کنند. از نظر هندسی، افراد در یک دوتایی را می توان با انعکاس در صفحه تقارن یا با چرخش حول محور با یکدیگر ترکیب کرد. L 2. دوتایی ها می توانند از یک جفت کریستال (ساده) یا از افراد تکرار شونده تشکیل شوند. ویژگی مشخصهدوقلوهای وجهی زوایای ورودی بین چهره ها هستند. چنین زوایایی بر روی بلورهای منفرد به طور ایده آل وجود ندارد. لازم است بین دوقلوهای همجوشی و دوقلوهای جوانه زنی تمایز قائل شد. در اول، افراد در طول هواپیما مشخص می شوند، به نظر می رسد که آنها با یکدیگر در تماس هستند. ثانیاً، کریستال ها، همانطور که بود، بیش از حد یکدیگر رشد می کنند یا از طریق و از طریق یکدیگر نفوذ می کنند، و در امتداد یک سطح پیچیده سینوسی (پله ای) لمس می شوند. دوقلوها به دلایل مختلفی تشکیل می شوند. در محلول، زمانی که کریستال ها هنوز در حالت هسته هستند و تحت تأثیر نیروهای خاصی نسبت به یکدیگر به دور خود می چرخند. در طول انتقال از یک اصلاح چند شکلی به دیگری. تحت تأثیر مکانیکی در رشد کریستال ها.
کریستال های کاذب–شبه شکل ها
پسودومورفوزیس بلور یا دانه ای از کانی است که بدون تغییر شکل آن با کانی دیگری یا مخلوطی از کانی ها جایگزین شده است، از این رو به شکل کاذب (شبه) (مورف) نامیده می شود. این تشکیلات اغلب حتی کوچکترین جزئیات سطح کریستال ها و دانه های اصلی را حفظ می کنند (شکل 27).
برنج. 27. کوارتز توسط رگه های آزبست:
باصطلاح "چشم ببر" - زرد و "چشم شاهینی" - آبی
برای قضاوت می توان از پسودومورفوس استفاده کرد واکنش های شیمیاییتشکیل کانی، زیرا هم کانی اصلی (دانه) و هم محصول نهایی تبدیل به طور همزمان قابل مشاهده هستند. در شرایط سطحی، کریستال های پیریت با لیمونیت جایگزین می شوند - یک توده پودری قهوه ای متراکم، مخلوطی از هیدروکسیدهای مختلف Fe 3 + (شکل 28).

برنج. 28. شبه لیمونیت پس از بتن ریزی پیریت، 4 سانتی متر،
"صحرای سفید"، مصر
روش دیگر برای تشکیل شبه شکل، تبدیل چندشکلی مواد با تغییر دما و فشار است که به آنها پارامورفوس می گویند. به عنوان مثال، تغییر شکل کوارتز آلفا توسط کوارتز بتا ( تیتبدیل 575 0 С در 100 کیلو پاسکال). همچنین در توده سنگی بلورهای مواد معدنی محلول، نقش شبهمورفهای توخالی وجود دارد که محل آن خالی مانده است (شکل 29).

برنج. 29. کوارتز فلوریت
جایگزینی شبه شکل جزئی سطح با رسوب دهی بعدی نواحی جایگزین شده با کریستال های کوارتز. خود فلوریت متعاقباً حل شد و حفرههای مرکزی را به شکل یک مکعب منفی پشت سر گذاشت. نمونه 9cm، Kadamjai، قرقیزستان.
سنگدانه های معدنی
در طبیعت، کریستال های منفرد با چهره نسبتا کمیاب هستند، اغلب مواد معدنی خوشه های مختلفی را تشکیل می دهند - سنگدانه ها. در کانی شناسی، آنها معمولاً بر اساس مورفولوژی تقسیم می شوند: خاکی، دانه ای، متراکم، سنگدانه ها. دروس ها، برس ها، ترشحات، بتن ریزی ها، اولیت ها، اسفرولیت ها، سنگدانه های متخلخل، دندریت ها، حمله ها و لام ها.
سنگدانههای خاکی، دانههای خاکی دانههای معدنی بسیار ریز هستند. این نوع سنگدانه ها به طور گسترده در پوسته زمین وجود دارد. سنگدانههای دانهای تودههای شل یا پیوسته از دانههای رشد یافته تصادفی یک کانی (تک معدنی) یا چند کانی (چند معدنی) هستند. هر دانه یک کریستال بریده نشده و شکل نیافته است که در شرایط تنگ رشد کرده است. بسته به اندازه دانه، آنها به دانه درشت (> 5 میلی متر)، دانه متوسط (1 تا 5 میلی متر)، دانه ریز (<1 мм). Характерный пример – полнокристаллические магматические породы (граниты и пр.).
برنج. 30. سنگدانه گرانیت آمازونیت دانه متوسط
در میان کانی ها، او سه گروه را که ظاهر مشخصی از کریستال ها دارند، متمایز می کند:
- ایزومتریک، به طور مساوی در هر سه جهت توسعه یافته است - مگنتیت، پیریت، گارنت.
- کشیده در یک جهت، منشوری، ستونی، سوزنی و تابشی، - باریت، کوارتز.
- کشیده در دو جهت جدولی، ورقه ای، شاخ و برگ و فلس دار، - کلریت و غیره.
مطابق با ظاهر بلورها، انواع مختلفی از سنگدانه های معدنی تشکیل می شوند: برگی (a)، فلس دار (b)، فیبری (c) و (d)، تابشی شعاعی (e)، ستونی (f) (شکل 31). ).
آ  ب
ب 
که در  جی
جی 
د  ه
ه 
برنج. 31. دانه های برگی - تالک ( آ)، سنگدانه فلس دار متوسط - پاراگونیت ( ب)، سنگدانه الیاف بلند - آزبست کریزوتیل ( که در)، سنگدانه شعاعی - تابشی - aegirine (d)، سنگدانه ستونی - کیانیت (e)، سنگدانه فیبری - سلنیت گچ (e)
ستونی موازی (شکل 31، ه) و سنگدانه های فیبری (شکل 31 که در, جی) معمولاً در ترک ها تشکیل می شوند. اینها رگه هایی از گچ ابریشمی، آزبست سرپانتین، کلسیت ستونی هستند. در برخی موارد، این سنگدانه ها در شکاف های باز متبلور می شوند: اول، دروس ها بر اساس اصل انتخاب هندسی روی دیوارها رشد می کنند. که به سمت یکدیگر رشد می کنند، بسته می شوند و سنگدانه های ستونی یا فیبری موازی را تشکیل می دهند. در برخی دیگر، چنین سنگدانههایی در ترکهایی که به تدریج باز میشوند، زمانی که نرخ باز شدن کمتر یا برابر با نرخ رشد افراد است، تشکیل میشوند. ابتدا ترک با یک سنگدانه معدنی دانه ای به شکل یک رگه نازک پیوسته پر می شود. سپس، همانطور که دانه ها باز می شوند و در مقابل یکدیگر قرار می گیرند، تنها پس از دیواره های در حال گسترش شکاف می توانند رشد کنند. آنها به تدریج به طور معمول به دیوارها کشیده می شوند و یک سنگدانه ستونی یا فیبری موازی را تشکیل می دهند.
سنگدانه های زینتر شده
اشکال متخلخل تشکیلات معدنی به دلیل محلول های کلوئیدی - ژل ها بوجود می آیند. محلول های کلوئیدی که به آرامی مهاجرت می کنند، در حفره ها می افتند، دیواره های آنها را می پوشانند، به تدریج آب خود را از دست می دهند و ضخیم می شوند. در نتیجه، اشکال مختلفی از سنگدانه ها تشکیل می شوند:
- استالاکتیت ها - تحت تأثیر گرانش از قسمت های بالایی حفره ها آویزان می شوند.
- استالاگمیت ها - در قسمت های پایین حفره ها به دلیل ریزش قطرات تشکیل می شوند.
- سنگدانه های کلیه شکل - رایج ترین در بین اشکال زینتر، در شرایط سطحی رخ می دهد.
اندازه این سازندها متفاوت است: از میکروسکوپی گرفته تا لایه های بزرگ ستون مانند در غارها. انواع کانی ها را می توان به شکل زینتری یافت: هیدروکسیدهای آهن و منگنز، اوپال، مالاکیت، گچ، آراگونیت، کلسیت و غیره.
دروس ها (برس ها) گروهی از کریستال ها هستند که به صورت عمود یا تقریباً عمود بر سطح شکاف ها، دیواره های رگ یا حفره ای در سنگ رشد کرده اند. اول، تک بلورها رشد می کنند، رشد می کنند، با یکدیگر تماس پیدا می کنند، در مقابل یکدیگر قرار می گیرند و از رشد خود جلوگیری می کنند. فقط آن کریستال هایی به رشد خود ادامه می دهند که بردار رشد آنها به سمت فضای آزاد جهت گیری می کند، یعنی. نرمال به سطح ترک نمونه های دروز در شکل نشان داده شده است. 32 آو ب.
آ  ب
ب 
برنج. 32. دروس کوارتز ( آ)، قلم مو از کریستال های آمتیست ( ب)
ترشحات زمانی ایجاد می شوند که هر حفره ای در سنگ با مواد معدنی پر شود. اغلب در مرکز ترشحات دروزن وجود دارد. اغلب ترشحات کلسدونی با کوارتز دروزن در داخل، محدود به لوزه ها در بازالت. ترشحات دارای حفره های داخلی ژئود نامیده می شوند (شکل 33).

برنج. 33. عقیق کلسدونی قهوه ای تیره با درز کوارتز در مرکز
بتن یک سنگدانه معدنی کروی (گاهی اوقات به صورت مسطح، به طور نامنظم گرد) با ساختار تابشی شعاعی است (شکل 34). بر خلاف ترشحات (ژئودها)، آنها در اطراف یک مرکز رشد می کنند. در مرکز بتن، اغلب دانه ای وجود دارد که در طول رشد آن به عنوان دانه عمل می کند. اغلب، بتن ریزی در سنگ های رسوبی متخلخل - ماسه ها و رس ها تشکیل می شود. اندازه این سازندها از میلی متر تا ده ها سانتی متر و گاهی حتی تا یک متر یا بیشتر متغیر است. آنها از نظر شکل و ساختار متفاوت هستند. بتن ریزی ها می توانند کریستالی متراکم (تابشی یا دانه ای) باشند. کریپتوکریستالین (چخماق)؛ سست و خاکی (لیمونیت، ویویانیت).
سنگهای رسوبی اغلب حاوی بتنهایی از پیریت، مارکازیت، سیلیس (کوارتز، کلسدونی، سنگ چخماق)، کربناتها و فسفریتها هستند. گرههای فرومنگنز مورد توجه علمی و عملی هستند؛ آنها در مقادیر زیادی در کف اقیانوس شکل میگیرند و به عنوان یک منبع مواد خام امیدوارکننده در آینده در نظر گرفته میشوند.
انواع عجیب و غریب از گره های ترکیب کربناته- آرژیلاسه، که فقط در سنگ های رسوبی یافت می شود و با وجود ترک های خشک کننده متعدد در داخل مشخص می شود، سپتاریا نامیده می شود (شکل 35).
. 

برنج. 34. ندول شکل. 35. سپتاریا
اولیت ها تشکیلات کروی یا بیضی شکلی از کربنات کلسیم، اکسیدهای آهن و منگنز، سیلیس و غیره هستند که دارای ساختار پوسته ای متحدالمرکز و گاهی تابشی شعاعی (در اطراف هسته مرکزی) هستند. هسته می تواند قطعاتی از پوسته، دانه های ماسه، سنگریزه و غیره باشد. مواد معدنی مانند کلسیت، آراگونیت و پیرولوزیت اغلب به شکل اولیت یافت می شوند.
اولیت ها در طی ته نشینی (در حالت تعلیق، در آب)، در طی دیاژنز و در طی مراحل دیگر تبدیل رسوب در طی گردش محلول ها در حفره ها تشکیل می شوند. اغلب، اولیت ها در چشمه های آب گرم، در دریاچه های نزدیک به پایین و سیلت های دریایی تشکیل می شوند.
آنها اغلب در سنگهای آهک، سنگهای آهن، بوکسیتها (شکل 36)، سنگهای سیلیسی و غیره یافت میشوند. اندازه اولیتها از میلیمتر تا چند سانتیمتر است. اولیت های بزرگتر از 2 تا 5 میلی متر پیزولیت نامیده می شوند.

برنج. 36. بوکسیت اولیتی
اسفرولیت ها و سنگدانه های کلیه شکل به دلیل مورفولوژی آنها نامگذاری شده اند. اسفرولیت ها اغلب دارای شکل و اندازه کروی تقریباً منظم از کسری تا 1-2 سانتی متر یا بیشتر هستند. آنها مانند توپ روی سایر مواد معدنی و روی دیواره های حفره های مختلف در سنگ معدن و سنگ رشد می کنند. اسفرولیت ها یا در نتیجه رشد شکافته کریستال ها تشکیل می شوند یا در آنها، مانند بتن، هسته-دانه ای وجود دارد که ماده معدنی روی آن رشد می کند. به دلیل انتخاب هندسی یا شرایط محدود، کریستال ها می توانند تنها با تابش از مرکز اسفرولیت رشد کنند (شکل 37).
برنج. 37. اسفرولیت
سنگدانه های Reniform از بسیاری از جوانه های به هم پیوسته تشکیل شده اند، که هر یک مانند یک کروی دارای ساختار تابشی شعاعی هستند (شکل 38). سنگدانه های رنیفرم گوتیت HFeO 2 H 2 O و مالاشیت Cu 2 (CO 3) (OH) 2 دارای ساختاری خاص هستند. شکل گیری آنها در یک سطح ناهموار به دلیل رشد گروهی و انتخاب هندسی اسفرولیت ها صورت گرفت. فقط آن اسفرولیت هایی که روی برآمدگی های زیرلایه قرار داشتند باقی ماندند و رشد کردند. اغلب سنگدانه های کلیه شکل در حفره های مختلف در مناطق نزدیک به سطح تخریب و هوازدگی سنگ ها و سنگ ها تشکیل می شوند.

برنج. 38. سنگدانه رنیفرم هماتیت شعاعی تابشی
دندریت ها شکل هایی به شکل شاخه های درخت هستند که به دلیل رشد سریع کریستال ها در برخی جهات به وجود آمده اند. آنها در سطح سنگ ها در امتداد شکاف های نازک رخ می دهند. دندریت ها به ویژه مشخصه اکسیدهای منگنز هستند (شکل 39).

برنج. 39. دندریت های اکسید منگنز (ورنادیت) روی سینیت
توده های خاکی تشکیلات مخفی-دانه ای نرم و نرم هستند. آنها اغلب به شکل پوسته ها و انباشتگی ها مشاهده می شوند که اغلب در هنگام هوازدگی شیمیایی سنگ ها و سنگ ها رخ می دهند. بسته به رنگ، تودههای خاکی را دوده (تودههای سیاه هیدروکسید منگنز)، اخرو (تودههای زرد قهوهای هیدروکسیدهای آهن) میگویند.
