הנוסחה של המינרל אשר. הרכב כימי של מינרלים, חישוב נוסחאות
לכל מינרל יש הרכב כימי ספציפי. עשוי להיות מורכב מיסוד כימי אחד או מכמה. אם מינרל מורכב מיסוד כימי אחד, הוא נקרא יסוד מקומי. לדוגמה, יליד, כסף יליד, יליד, וכו '. עם זאת, רוב המינרלים מורכבים מכמה, ולפעמים הרבה יסודות כימיים. הרכב המינרלים מתבטא בדרך כלל בצורה של נוסחה כימית או באחוז משקל, הנקבע באמצעות ניתוח כימי.
לדוגמה, ההרכב הכימי של כלקופיריט ומינרלים אנלסיים יכול להתבטא כאחוז המשקל הבאים של יסודות כימיים (עבור הראשון) או תחמוצות (עבור השני):
I. (Cu - 34.9) + (Fe - 30.47) + (S - 34.6) = סכום 99.97
II. (SiO 2 - 55.12) + (Al 2 O 3 - 22.99) + (Na 2 O - 13.53) + (H 2 O - 8.27) = סך הכל 99.81
הנוסחאות למינרלים אלו מחושבות על ידי חלוקת כמויות המשקל המצוינות במשקלים האטומיים או המולקולריים המתאימים. במקרה זה מתקבלות כמויות אטומיות או מולקולריות. המסות האטומיות של יסודות כימיים נלקחות מהטבלה של מערכת היסודות המחזורית של D. I. מנדלייב, המשקל המולקולרי של התחמוצת נגזר על ידי סיכום המסות האטומיות המרכיבות את תחמוצת היסודות המקבילה. כמויות אטומיות או מולקולריות מוחלפות במקדמים היחסיים שלהן בנוסחה המתקבלת. דוגמאות לחישוב הנוסחה של כלקופיריט ואנלסיים ניתנות בטבלה. 7.
הנוסחאות שהתקבלו במהלך החישוב ונותנות מושג על ההרכב הכימי של המינרל נקראות אמפיריות. אלו הן הנוסחאות שהתקבלו של כלקופיריט ואנלסיים - 4Si02 Al203 NagO 2H20. הנוסחה האמפירית של analcime, הכתובה בצורה של תחמוצות, אינה משקפת את היחסים בין יסודות כימיים ואינה אומרת דבר על מבנה המינרל, לכתיבת נוסחה כזו יש יתרון אחד - קל יותר לזכור אותה.
| חישוב מחדש של נתוני ניתוח כימי והקמת נוסחת המינרלים טבלה 7 | ||||
| רכיבים | אחוזי משקל | כמויות אטומיות (מולקולריות). | יחסים בין אטומים (מולקולריים). | שם ונוסחה של המינרל |
| Cu | 34,9 | 34,9: 63,5 = 0,550 | 1 | CuFeS2 |
| Fe | 30,47 | 30,47: 55,8 = 0,546 | 1 | |
| ס | 34,6 | 34,6: 32 = 1,081 | 2 | |
| SiO2 | 55,12 | 55,12: 60 = 0,919 | 4 | 4SiO2 Al2O3 Na2O 2H2O |
| Al2O3 | 22,99 | 22,99: 102 = 0,225 | 1 | |
| Na2O | 13,53 | 13,53: 62 = 0,218 | 1 | |
| H2O | 8,27 | 8,27: 18 = 0,459 | 2 | |
למספר מינרלים נהוג לכתוב נוסחאות המשקפות את סוג התרכובת הכימית ואת הקשרים ההדדיים בין היסודות הכימיים המרכיבים. נוסחאות כאלה נקראות כימיקלים מבניים או גבישיים. הנוסחה של analcime היא Na H 2 O; הוא מבני. הסוגריים המרובעים מדגישים את הרדיקל, המייצג קומפלקס אניוני מורכב, הקיים במינרל בכמות של מולקולה אחת, כתוב בסוף הנוסחה ומופרד ממנו בנקודה. דוגמה אחרת. הנוסחה האמפירית של מוסקוביט היא H 2 KAl 3 Si 3 O 12, הנוסחה המבנית היא KAl 2 (OH, F) 2. בנוסחה זו קומפלקס אניוני מורכב מבודד כרדיקל, והוא קיים במינרל לא בצורה של H 2 O, אלא בצורה של הידרוקסיל (OH) - , אותו ניתן להחליף מפסיק אחר. היסוד הכימי מלכתחילה בסוגריים קיים בכמות גדולה יותר. לדוגמה, נוסחת האנקריט היא Ca (Mg, Fe) 2 2 . ניתוח עקיפה של קרני רנטגן איפשר כעת לקבוע את הנוסחאות המבניות של מינרלים רבים.
מושג המינרל והמינרולוגיה
מינרלים הם חומרים טבעיים (תרכובות כימיות, לעתים רחוקות יותר יסודות) בעלי תכונות כימיות ופיזיקליות מסוימות. המילה "מינרל" פירושה חתיכת עפרה, חתיכת עפרה.
סלע, כמו גרניט, הוא גם תוצר של תהליכים גיאולוגיים ב קרום כדור הארץ, לא יכול להיקרא מינרל, מכיוון שהוא הטרוגני פיזית וכימית ב חלקים שונים. הגרניט כולל הן קוורץ בהרכבו ובמבנהו, והן פלדספפור, נציץ, הנבדלים מקוורץ ומזה מזה.
מינרלוגיה היא המדע החוקר מינרלים. המינרלוגיה המודרנית חוקרת את מקורם (בראשית) של מינרלים, דפוסי תפוצתם בטבע (פרגנזה), וכן את התנאים להפיכתם למינרלים אחרים, שכן כל אחד מהמינרלים נוצר ויציב בטווח טמפרטורות מסוים, לחץ וריכוז של יסודות כימיים. משימת המינרלוגיה כוללת גם את חקר המורפולוגיה (המראה), תכונות גשמיות, הרכב כימי ומבנה פנימי של מינרלים.
מינרלים חשובים בכלכלה הלאומית: הם משמשים כחומרי בניין, יקרים ו אבנים חצי יקרות, עפרות של מתכות ברזליות, לא ברזליות ונדירות, עפרות חקלאיות וכו'.
החיפוש אחריהם הוא רציונלי רק על בסיס ידע על חוקי היווצרות מינרלים בסביבה טבעית מסוימת.
המינרלוגיה קשורה קשר הדוק עם כל המחזור של מדעי הגיאולוגיה: גיאולוגיה, פטרוגרפיה וגיאוכימיה, חקר המינרלים. המינרלוגיה קשורה גם למחזור של מדעי הפיזיקה והכימיה: כימיה, פיזיקה, קריסטלוגרפיה.
קרום כדור הארץ מורכב ממינרלים. כ-2000 מהם ידועים. רובמינרלים בטבע נמצאים במצב מוצק; מינרלים נוזליים (כספית, מים, נפט וכו') וגזים ( פחמן דו חמצני, גזים דליקים, מימן גופרתי, דו תחמוצת הגופרית וכו').
אנשים למדו מזמן ליצור מוצרים סינתטיים הדומים בתכונות, בהרכב ובמבנה למינרלים. הם נקראים מינרלים מלאכותיים (לדוגמה, קוורץ, קורונדום, נציץ וכו').
שמות המינרלים ניתנים לפי תכונות פיזיקליות אופייניות (לדוגמה, מגנטיט), לפי הרכב כימי (פיריטים גופרית) או לפי מקום הגילוי הראשון (לברדור, על שם חצי האי לברדור ב צפון אמריקה), לכבוד מדענים או אישי ציבור (ביוטיט - נציץ שחור, לכבוד הפיזיקאי ביוט). לרוב המינרלים יש מספר שמות.
^
הרכב כימי ונוסחה של מינרלים
הרכב המינרל נקבע בניתוח כימי במעבדה. ראשית, התוכן של תחמוצות או יסודות בודדים נקבע כאחוז, ואז הנתונים המתקבלים מתבטאים על ידי הנוסחה הכימית של המינרל.
לדוגמה, ניתוח כימיפיריט נחושת (כלקופיריט) נותן את ההרכב הבא: Fe = 30.27%; Cu= 34.98%; S = 35.75%.
כדי לקבוע את הנוסחה הכימית, יש צורך לחלק את המספרים שהתקבלו במהלך הניתוח במשקלים האטומיים או המולקולריים המתאימים. לאחר מכן, הכמויות האטומיות או המולקולריות של יסודות או תחמוצות מושווים זה לזה ומוצאים את היחסים המרובים שלהם. הם משמשים כמקדמים בנוסחה הכימית של המינרל (טבלה 3).
שולחן 3
דוגמה לקביעת הנוסחה של כלקופיריט
| יסודות כימיים | כמות החומר, % | כמויות אטומיות | היחס בין הכמויות האטומיות | נוּסחָה |
| Fe | 30,27 | 1 | CuFes 2 |
|
| Cu | 34,98 | 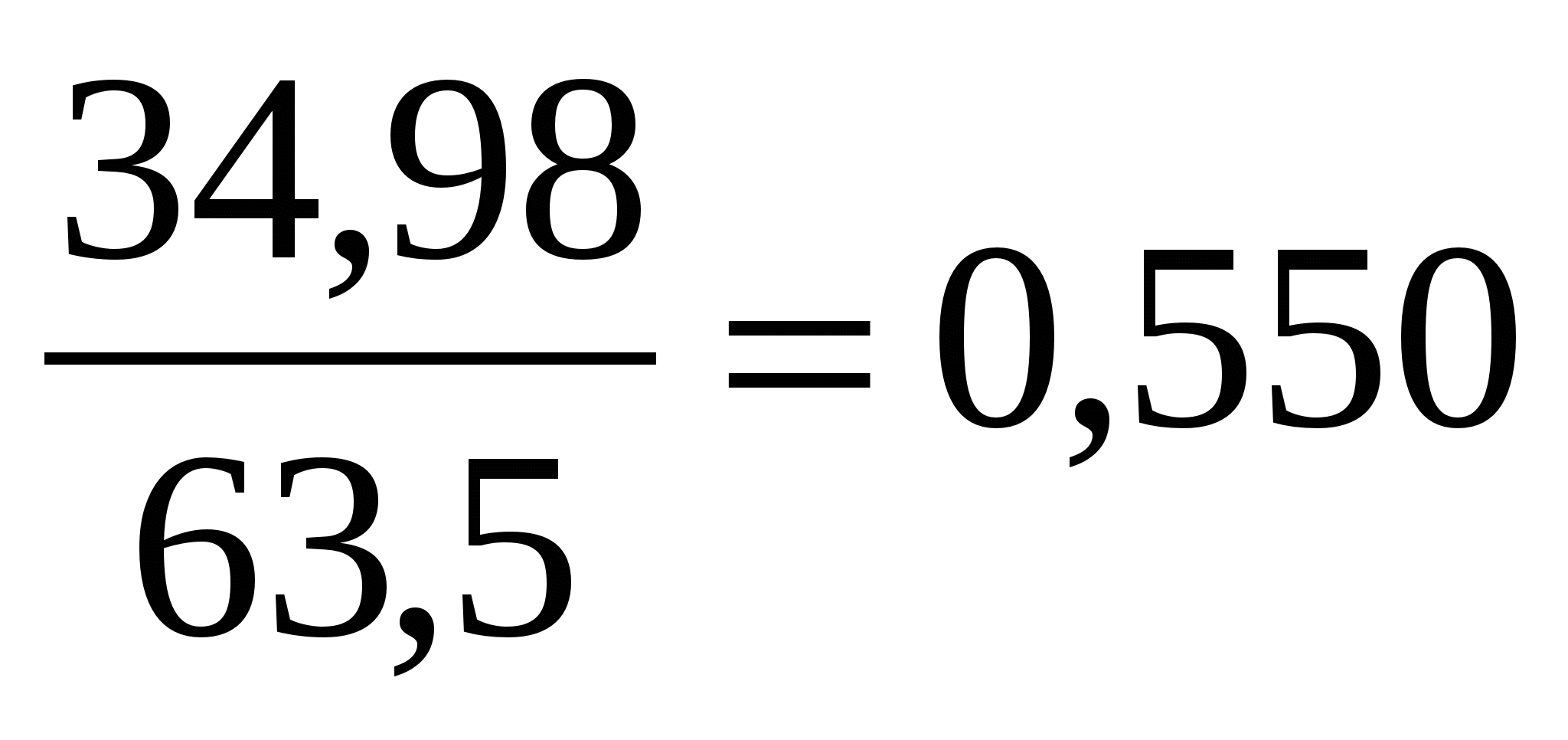 | 1 |
|
| ס | 35,75 |  | 2 |
הנוסחה של כלקופיריט מבטאת את הרכבו הכמותי, אך אינה נותנת מושג על השילובים ושיטות החיבור בין היסודות. המקדמים בנוסחה הכימית מראים רק את הקשר בין היסודות המרכיבים את המינרל הזה.
לצד נוסחאות כימיות אמפיריות, נעשה שימוש גם בנוסחאות מבניות, הנותנות מושג לא רק על ההרכב הכימי, אלא גם על המיקום המרחבי.
אטומים במינרל והקשרים שלהם זה עם זה. לדוגמה, הנוסחה האמפירית של המינרל מלכיט היא H 2 Cu 2 CO 5, והנוסחה המבנית, המוצגת במישור:
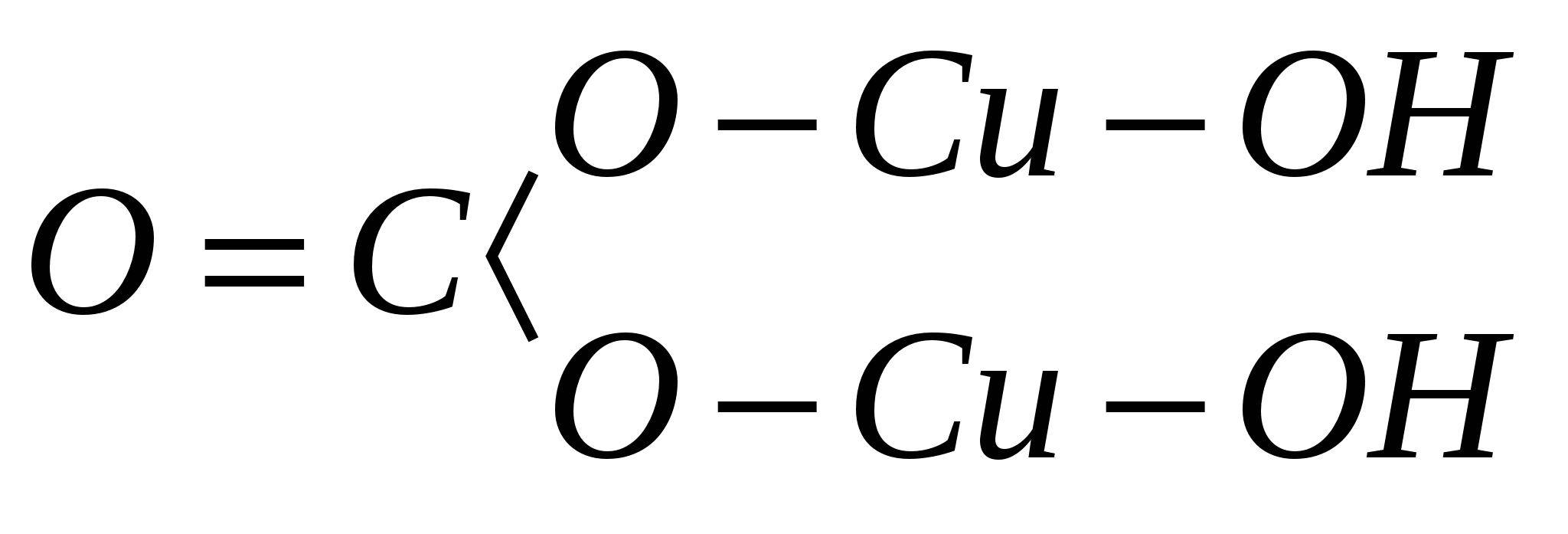
לאור האמור לעיל, ניתן לכתוב את הנוסחה לעיל למינרל מלכיט בצורה הבאה: Cu 2 (OH) 2 CO 3. מנוסחה זו המבוססת על העיקרון המבני, עולה כי מים קשורים בחוזקה לנחושת, לא בצורה של H 2 O, אלא בצורה של הידרוקסיל (OH) 1-.
שיטת הרנטגן מאפשרת לחשוף את הקשרים בין אטומים במבני הגביש של מינרלים, ולעתים גם את מיקומם של האחרונים בחלל. מדע כימיה הגבישים עוסק בקשר בין כימיה למבנה החומר ותכונותיו.
נכון להיום, ישנן דרכים רבות לכתוב את הנוסחאות הכימיות של מינרלים, תלוי מה בדיוק הם רוצים להעביר עם הנוסחה. לדוגמה, הנוסחה המבנית של אורתוקלאז K[(AlSi 3)O 8 ] מאפיינת את סוג התרכובת הכימית ואת הקשרים ההדדיים בין יסודות בודדים. כדי לשקף את ההרכב האיכותי של הרכיבים (היסודות) החשובים ביותר ואת היחסים הכמותיים שלהם, יש להציג את נוסחת האורתוקלאז בצורה של תחמוצות K 2 O A1 2 O 3 -6Si0 2.
ההרכב הכימי של רוב המינרלים אינו יכול להיות מבוטא במדויק על ידי נוסחה. זה תלוי בזיהומים מכניים שונים במינרלים וביכולת של כמה תרכובות ליצור תערובות איזומורפיות או תמיסות מוצקות.
זיהומים יכולים להיות מכניים, גסים, מופרדים בקלות, או עדינים מאוד, מופרדים בקושי רב. הופעת זיהומים מתרחשת עקב לכידת חומר זר על ידי המינרל הגדל. נוכחותם של זיהומים גסים רגילים אינה משפיעה על הנוסחה של המינרל.
איזומורפיזם (מיוונית "isos" - שווה ו"מורפה" - צורה) היא יכולתם של חומרים הדומים בהרכב הכימי ובתכונות הגבישיות לתת גבישים מעורבים, כלומר. לבנות סריג גביש משותף במהלך התגבשות מהמסות או תמיסות. גבישים כאלה נקראים תערובות איזומורפיות. יש להם הרכב משתנה; אחרת הם נקראים פתרונות מוצקים.
מנקודת מבט של כימיה ומבנה סריג הגביש, מבחינים בשני סוגים עיקריים של איזומורפיזם: איזו-וולנטי והטרו-וולנטי.
עם איזומורפיזם איזו-ולנטי, ליונים המחליפים זה את זה יש ערכיות זהה, בסריג הגבישי מוחלפים חלקיקים מאותה ערכיות - יון אחד בשני. זהו המקרה הפשוט ביותר של היווצרות של גבישים מעורבים. הנוסחאות הכימיות של חומרים איזומורפיים במקרה זה דומות לחלוטין, נבדלות רק ביון אחד, בדרך כלל קטיון, כמו, למשל, באוליבינים. אוליבינים המתגבשים במערכת המעוינת הם תערובת איזומורפית של שני חומרים: פורסטריט Mg 2 ו-faayalite Fe 2, המופיעים גם כמינרלים עצמאיים (גם מערכת מעוינת); הנוסחה של אוליבין היא: (Mg, Fe) 2 . הפסיק בין יוני Mg 2+ ו- Fe 2+ בנוסחה זו אומר שהם יכולים להחליף זה את זה בכל כמות, וליצור סדרה רציפה של תרכובות בהרכב ביניים. האלמנט הדומיננטי בדרך כלל ממוקם ראשון.
האיזומורפיזם ההטרוולנטי מורכב יותר: בסריג הגבישי מוחלפים יונים בעלי ערכיות שונות, אך האיזון האלקטרוסטטי משוחזר כך שסכום הערכיות של הזוגות המחליפים שווה. דוגמה קלאסית להחלפה מורכבת שכזו הם מינרלים מקבוצת הפלדספר - פלגיוקלאזים. פלגיוקלאזים הם סדרה איזומורפית רציפה של מינרלים המתגבשים בסירגון הטריקליני, כאשר זוג יוני Ca 2+ A1 3+ מוחלף בזוג של Na + Si 4+. האיברים הקיצוניים בסדרה זו - אנורתיט Ca [(A1 2 Si 2)O 8] ואלביט Na [(A151 3)O 8] - מופיעים גם כמינרלים עצמאיים. במקרה זה, יש את אותה ערכיות כוללת של קבוצות התחליפים (5 ו-5); כאשר NaSi מופחת מנוסחת האלביט ו-CaA1 מנוסחת האנורתית, השאר זהה עבור שתי הנוסחאות - AlSi 2 O 8.
בהתאם לשינוי בהרכב, משתנות גם התכונות הפיזיקליות של חומרים איזומורפיים. לדוגמה, מאפיינים אופטיים של פלגיוקלאזים משתנים, וזה הבסיס לאבחון שלהם במהלך מחקר גבישי-אופטי. באוליבינים צבע המינרל משתנה מירוק לשחור ונקודת ההיתוך יורדת עם עלייה בתכולת הפייליט.
לפי מידת השלמות של תחליפים איזומורפיים, ניתן להבחין בשני מקרים. במקרה הראשון, ההחלפה של אלמנט אחד באחר יכולה להיות עד 100% - זהו איזומורפיזם מושלם, או מלא, (אוליבינים, פלגיוקלאזים). במקרה השני, ההחלפה יכולה להיות חלקית - ממאות ועד כמה אחוזים. זהו איזומורפיזם לא מושלם, או מוגבל. אז, קלציט Ca [CO 3 ] ומגנזיט Mg [CO 3 ] נותנים רק תרכובת אחת בהרכב ביניים - דולומיט CaMg [CO 3 ] 2 . היעדר פסיק בין Ca ל-Mg בנוסחת הדולומיט מעיד שכאן יש לנו תרכובת כימית בהרכב מסוים, ולא תערובת איזומורפית.
אלמנטים שיכולים להחליף זה את זה בצמתים של סריג הגביש (תופסים בו את אותו מיקום) מבלי להפר את המבנה שלו נקראים איזומורפיים זה עם זה ושייכים לאותה סדרה איזומורפית. הרעיון של סדרה איזומורפית של יסודות הקשורים למערכת המחזורית של מנדלייב פותחה על ידי האקדמאי V.I. Vernadsky. בקונכיות תרמודינמיות שונות של קרום כדור הארץ, סדרות איזומורפיות אלו שונות, כלומר. שינוי בהשפעת טמפרטורה ולחץ. מדוע, אם כן, אטומים או יונים של יסוד נתון יכולים להחליף אטומים (יונים) של רק חלק מהיסודות, ולא של כולם, בסריג הגביש? כדי להבין זאת, נסו לדמיין את סריג הגביש לא כמערכת של נקודות המופרדות על ידי פערים ריקים גדולים (כפי שבדרך כלל מתואר סריג מרחבי), אלא כמערכת של כדורים נוגעים. כל כדור הוא תחום הפעולה של אטום (יון), כלומר חלל שאליו, בהתאם לחוקי האינטראקציה של מטענים חשמליים, אטומים (יונים) אחרים המוקפים בכדורים האטומיים (יוניים) שלהם אינם יכולים לחדור.
לפיכך, המרחקים בין אטומים מסוימים (יונים) של הסריג בתנאים מסוימים של טמפרטורה ולחץ הם קבועים בהחלט ונקבעים על ידי חוקי האלקטרוסטטיקה. גם רדיוסי ספירות הפעולה של אטומים (יונים), המכונים רדיוסים אטומיים (יוניים), קבועים. (ר אני ) 1 .
מדידת הרדיוסים האטומיים והיוניים הראתה שרק אותם יסודות שהרדיוסים האטומיים (יוניים) שלהם קרובים זה לזה הם איזומורפיים זה עם זה. ההבדל בגודל הרדיוסים של יונים המחליפים זה את זה לא יעלה על 15% מהרדיוס של הקטן מבין היונים.
הבה נסביר את הנאמר בעזרת דוגמאות. סדרה איזומורפית רציפה ידועה בקרבונטים של מגנזיט Mg [СО 3] וסידריט Fe [С0 3] בשל הקרבה הקרובה של הרדיוסים האטומיים (יוניים) של מגנזיום וברזל ברזל: ר אני Mg 2+ =0.74Å; ר אני Re 2+ =0.80Å. האיברים בסדרה זו יכולים לבוא לידי ביטוי בנוסחה (Mg, Fe) [CO 3 ] או (Fe, Mg) [CO 3 ]; כאן הפסיק מציין שיוני Mg ו-Fe מתנהגים כמו אטומים של אותו יסוד. אבל עבור Halite NaCl ו-Sylvin KS1, שמתגבשים בסירגון הקובי, עם האנלוגיה של ההרכב הכימי, לא נצפים יחסים איזומורפיים (בטמפרטורה רגילה), שכן הגדלים של הרדיוסים היוניים שלהם שונים מאוד ( ר אני Ma + = 0.98 Å, ו ר אני K + = 1.33 Å).
תופעת התחליפים איזומורפיים אינה נשארת ללא שינוי בתנאים חיצוניים שונים. בטמפרטורות גבוהות ההחלפה מתרחשת ביתר קלות, וחומרים רבים שאינם איזומורפיים בטמפרטורות רגילות הופכים לאיזומורפיים בטמפרטורות גבוהות. לדוגמה, אלקליין ספירי שדה, אורתוקלאסים K [(А1Si 3)О 8 ] ואלביט Na [(А1Si 3)О 8 ] עם התגבשות ממאגמה יוצרים סדרה איזומורפית רציפה (К, Na) [(А1Si 3)0 8 ], אבל אז, כמו הטמפרטורה יורדת, זה התערובת האיזומורפית שוב מתפרקת במצב מוצק לשני מינרלים עצמאיים: אחד עם תכולת אשלגן דומיננטית - אורתוקלאז והשני עם תכולת נתרן דומיננטית - אלביט. תופעה זו נקראת פירוק של תמיסות מוצקות.
1 רדיוסים יוניים (אטומיים) נמדדים באנגסטרום (Å); 1 Å = 10-8 ס"מ.
רוב המינרלים מכילים זיהומים איזומורפיים בכמויות שונות. הקבוצות החשובות והנפוצות ביותר של סיליקטים (אוליבין, פירוקסנים, אמפיבולים, ספירי פלד) הן תערובות איזומורפיות.
איזומורפיזם מסייע להבין את הסיבות לאסוציאציות רבות של יסודות בקרום כדור הארץ ומאפשר לחזות במספר מקרים את נוכחותם של יסודות נדירים (פזורים) מסוימים בעלי ערך מסחרי במינרלים נרחבים רבים. כך, למשל, גרמניום מוסווה על ידי סיליקון, צסיום, רובידיום - על ידי אשלגן וכו '.
פולימורפיזם (מיוונית "פולי" - רבים ו"מורפה" - צורה), או ריבוי צורה, היא היכולת של חומר להתגבש עם אותו הרכב כימי במבנים שונים הקשורים ל סוגים שוניםסימטריה או סינגוניה. זנים נפרדים של אותו חומר, בעלי מבנה שונה, נבדלים בתכונותיהם. הם מינרלים - זנים פולימורפיים (שינויים) של חומר נתון. התרחשותם של כאלה מוסברת על ידי התנאים הפיזיקליים הכימיים השונים של היווצרותם (טמפרטורה, לחץ) ואופי הסביבה. זנים פולימורפיים של אותה תרכובת כימית מקבלים שמות שונים או מסומנים באותיות האלפבית היווני α, β, γ.
הדוגמה הקלאסית לפולימורפיזם היא פחמן. הוא מתגבש בשתי מערכות: מעוקב - יהלום ומשושה - גרפיט. המאפיינים של שני המינרלים הללו שונים מאוד זה מזה. יהלום יוצא דופן בקשיותו הגבוהה, הוא הקשה מכל המינרלים המוכרים לנו, הוא אינו מוליך חשמל. הגבישים חסרי הצבע והשקופים שלו הם בעלי ברק חזק בצורה יוצאת דופן.
לגרפיט תכונות שונות לחלוטין. הקשיות שלו קטנה (עפרונות גרפיט), מתפצלת בקלות לפתיתים, מוליכה היטב חַשְׁמַל. אגרגטים של גרפיט נבדלים על ידי האטימות שלהם וצבעם שחור או אפור פלדה.
גם הצפיפות שלהם שונה בתכלית: ליהלום יש צפיפות של 3.5 - 3.6, לגרפיט יש צפיפות של 2.2.
יהלום נוצר בטמפרטורה גבוהה ומאוד לחץ גבוה, בעומקים גדולים בתוך כדור הארץ, גרפיט - בעומק רדוד יותר, בטמפרטורות ולחצים נמוכים יותר.
הסיבה לתכונות השונות של היהלום והגרפיט נובעת מהמבנה שלהם, כלומר. סידור אטומי פחמן. בגרפיט, הקשר של אטומי פחמן פחות חזק מאשר ביהלום. מבנה הגרפיט מאופיין בסידור צפוף של אטומי פחמן במישורים מקבילים (איור 25). בכל שכבה ממוקמים אטומים בפינות של משושים רגילים וקיים ביניהם קשר חזק. בכיוון האנכי השכבות מופרדות זו מזו במרחקים גדולים, והקשר ביניהן חלש יותר. פולימורפיזם של מינרלים, שהם יסודות כימיים(פחמן, גופרית וכו') נקראת אלוטרופיה. השינויים המשושים, המעוינים והמונוקליניים של גופרית ידועים היטב.
תצורות מורכבות יותר נמצאות גם בצורה של זנים פולימורפיים שונים: CaCO 3, FeS 2 וכו'.
המעבר של זן פולימורפי אחד (מודיפיקציה) לאחר, הנגרם למשל משינוי בטמפרטורה, מתרחש באופן פתאומי, עם מבנה מחדש של המבנה במאפיין מסוים של זן זה (אם הלחץ נשאר ללא שינוי) ומלווה ב- שחרור או ספיגת חום.
הפוליפורמיזם של סיליקה (SiO 2 ) נחקר היטב, היוצר שלושה זנים עיקריים: קוורץ, טרידימיט וקריסטובליט, שלכל אחד מהם יש כמה שינויים. עם עלייה בטמפרטורה, קוורץ, שהוא יציב רק עד 573 מעלות צלזיוס, עובר ברציפות למספר שינויים פולימורפיים:
הידע על הטמפרטורות של טרנספורמציות פולימורפיות של קוורץ משמש למטרות מעשיות (לדוגמה, כדי להשיג טרידימיט, חומר עקשן שאינו עובר טרנספורמציות בטווח הטמפרטורות של 870-1470 מעלות צלזיוס, קוורץ מחומם מראש לטמפרטורה מעל 870 מעלות ג).
נוכחותם של שינויים פולימורפיים בסיליקה מאפשרת להשתמש בו כ"מדחום" גיאולוגי. על ידי מציאת שינוי פולימורפי כזה או אחר בין סלעיםומשקעי ורידים, אנו יכולים לשפוט את מרווחי הטמפרטורה שבהם התרחשה היווצרות הסלע.
להיווצרות מגוון פולימורפי של חומר, יש צורך במרווחים מסוימים של טמפרטורה ולחץ. עם שינוי בפרמטרים אלו הוא הופך לבלתי יציב ותיאורטית, עם הזמן, הוא אמור להפוך לזן שיציב בתנאים חדשים. אבל בשל הקצב הנמוך מאוד של סידור מחדש של סריג הגביש בטמפרטורות נמוכות, זנים פולימורפיים של חומר אחד יכולים להתקיים באותם תנאים במשך זמן רב כמעט אינסופי: האחד במצב יציב, השני במצב לא יציב יחסית (עבור לדוגמה, יהלום על פני כדור הארץ).
כבר הזכרנו לעיל שהרוב המכריע של המינרלים הטבעיים הם תרכובות כימיות. בין האחרונים ניתן למנות:
- א) מסויםחיבורים, גם בודדים וגם כפולים, ו
- ב) חיבורים הרכב משתנה.
גם בשימוש נרחב פתרונות מוצקים, או מה שנקרא תערובות איזומורפיות. יש להבחין בין תמיסות פסאודו מוצקות לבין תמיסות מוצקות אמיתיות אלה, בדיוק כפי שההבחנה הזו נעשית בתמיסות נוזליות.
לבסוף, יש לתת את הדעת במיוחד תרכובות מיםרעיונות לגביהם השתכללו משמעותית בשנים האחרונות.
תרכובות מסוימות. כל התרכובות הכימיות מסוימות, כידוע, מצייתות בקפדנות לחוק קביעות ההרכב, המתבטא בנוסחאות כימיות, חוק היחסים המרובים וחוק המניות, המחבר בין היחסים של מרכיבי תרכובת נתונה ליחסיהם באחרים. סוגי תרכובות. חוקים אלו עומדים בהתאמה מלאה למערכת היסודות המחזורית של D.I. Mendeleev, חוקי הכימיה של הגבישים ותורת הסימטריה במדיה גבישית.
זה אופייני שתרכובות אלו נבדלות במספר תכונות פיזיקליות מיוחדות הנראות בבירור בתרשימים הפיזיקוכימיים של נקודת התכה, מסיסות, מוליכות חשמלית, קשיות, משקל סגולי, מדדי שבירה וכו'.
תרכובות כימיות מסוימות כוללות:
- תחמוצות (Cu 2 O, MgO, Fe 2 O 3, SiO 2 וכו'),
- מלחי חמצן שונים (CaCO 3, CaSO 4, AlBO 3, Mg 2 SiO 4 וכו'),
- סולפידים (NiS, FeS 2, Sb 2 S 3 וכו'),
- תרכובות הלוגן (NaCl, AgBr, CaF 2 וכו') וכו'.
ההרכב הכימי של תרכובות כימיות יכול להיות מיוצג בשתי דרכים:
- בצורה של נוסחאות אמפיריות ו
- בצורה של נוסחאות חוקתיות או מבניות.
נוסחאות אמפיריות מבטאות את הרכב המינרלים או בצורה של יסודות הכלולים בתרכובת (לדוגמה, BaSO 4, Na 3 AlF 6, NaAlSi 3 O 8 וכו'), או בצורה של מספר תרכובות המרכיבות הפשוטות ביותר. BaO SO 3, 3NaF AlF 3, Na 2 O Al 2 O 3 6SiO 2 וכו'). הסוג האחרון של נוסחאות, למרות שהוא אינו תואם את הרעיונות המודרניים לגבי טבען של תרכובות כימיות, יש יתרון בכך שהוא מקל על זכירת הרכב המינרלים.
תיקונים משמעותיים במתאר של הנוסחאות של תרכובות מורכבות יותר נעשים על ידי נתוני כימיה גבישים המבוססים על מחקר עקיפות קרני רנטגן של מינרלים. מכיוון שרוב החומרים הגבישיים האנאורגניים מאופיינים בקשרים יוניים של יחידות מבניות, חשוב לשקף את היסודות המבניים הללו (יונים וקומפלקסים) המבוססים בסוגים שונים של מבנים גבישיים בנוסחאות של תרכובות כימיות. קומפלקסים אניונים במקרה זה מופרדים בדרך כלל מקטיונים על ידי סוגריים מרובעים, למשל, Mg 2, Ca 3 2, Mg 2, Na וכו'.
חיבורים כפולים. בנוסף לתרכובות כימיות פשוטות, תרכובות כפולות נפוצות בטבע, במיוחד מלחים כפולים. מלחים כפולים הם תרכובות ספציפיות כל כך המורכבות, כביכול, משני מלחים פשוטים הנמצאים ביחסים מרובים. ברוב המקרים, מלחים אלה הם כפולים בקטיונים, לעתים רחוקות יותר באניונים או בו זמנית בקטיונים ובאניונים. ניתן לתת את הדברים הבאים כדוגמאות: CaMg 2 , K 3 Na 2 וכו'.
כאשר משווים את הנוסחאות של מלחים כפולים, מתברר כי הקטיונים הכלולים בהרכבם, בשל השוני המשמעותי ברדיוסים היוניים שלהם, אינם יכולים להחליף זה את זה באופן איזומורפי: Ca 2+ (1.01, Å) ו-Mg 2+ (0.75 Å) ), K 1 + (1.33Å) ו- Na 1+ (0.98Å) וכו'. לכן, אין זה מפתיע שהם שונים מהמלחים הפשוטים המרכיבים אותם בתכונות מסוימות של מבני גביש ולעתים קרובות בתכונות פיזיקליות.
תרכובות בהרכב משתנה. בנוסף לתרכובות כימיות מסוימות, יש לא מעט תרכובות כאלה שהרכבן אינו קבוע, אלא משתנה בגבולות צרים או רחבים יותר, ולא ניתן להסביר את התנודות הללו בהרכב על ידי זיהומים מכניים של חומרים זרים. להיפך, ההרכב המשתנה של תרכובות מנקודת מבט כימית גבישית מוצא הסבר במסיסות המוגבלת של הרכיבים המרכיבים בתרכובת נתונה. תצורות כימיות כאלה נקראות תרכובות בעלות הרכב משתנה.
בין המינרלים, תרכובות בהרכב משתנה הן רבות למדי. ביניהם, קודם כל, נציין את המלחים הכפולים שבהם המלחים הפשוטים המרכיבים אותם, למרות שיש להם סריג קריסטל שנבנו באופן דומה, אינם מפגינים איזומורפיזם מוחלט בשל הבדל משמעותי בגדלים של רדיוסים יוניים או בשל הבדלים בתכונות הקיטוב. לכן, הם מאופיינים בתנודה חלקית של ההרכב, המתבטאת בהתכתבות לא מדויקת לנוסחאות הכימיות שלו עם יחסי רכיבים סטוכיומטריים לחלוטין.
בכמויות קטנות, זיהומים איזומורפיים של רכיבים אחרים נמצאים בהרבה מאוד תרכובות פשוטות ומורכבות. אלה כוללים, למשל, ספאלריט (ZnS), שבו תכולת הברזל בצורה של טומאה איזומורפית מגיעה לכמה אחוזים. דוגמאות רבות אחרות יינתנו בתיאור המינרלים.
תרכובות כימיות בעלות הרכב משתנה אינן שונות בתכונותיהן מתמיסות מוצקות ויש להתייחס אליהן ככאלה, אך עם שילוב מוגבל של הרכיבים.
פתרונות מוצקים. היכולת של חומרים גבישיים בעלי הרכב שונה ליצור תערובות של אותו מבנה גבישי, המשתנות בהרכבן באופן מתמיד, מבוססת במידה רבה על איזומורפיזם, כלומר, התכונה של יסודות להחליף זה את זה בתרכובות כימיות בהרכב קשור.
איזומורפיזם של שני חומרים מתרחש כאשר יש להם נוסחה כימית דומה וכאשר ליונים התואמים של שני החומרים יש אותו מטען בסימן, וגדלים של היונים ומידת הקיטוב שלהם אינם חורגים מגבולות ידועים, כלומר, הם שווה במידה מסוימת של דיוק.
בְּ תנאים טבעיים, למשל, נפוץ איזוולנטיאיזומורפיזם של Mg 2+ (רדיוס יוני הוא 0.75Å) עם יונים דו ערכיים Fe 2+ (0.79Å), Ni 2+ (0.74Å), Co 2+ (0.77Å), Zn 2+ (0 .79Å) ו-Mn 2 + (0.91Å). דוגמה נוספת היא איזומורפיזם של יונים תלת-וולנטיים: Fe 3+ (0.67Å), Cr 3+ (0.64Å) Al 3+ (0.57Å), Mn 3+ (0.70Å), V 3+ (0.65Å) , Ti 3 + (0.69Å). אותו הדבר חל על יחידות מבניות מורכבות המעורבות במבנה של סריג קריסטל, למשל, 2-, 2- וכו'.
עם זאת, יחד עם זה, הוכח ואושר בניסוי כי במהלך היווצרות של מינרלים בעלי הרכב משתנה במבנים גבישיים, לא רק יונים (או אטומים) פשוטים יכולים להיות מוחלפים ביונים (או אטומים) איזו-וולנטיים אחרים, אלא גם שלמים. ניתן להחליף קבוצות של יונים בקבוצות של יונים אחרים בעלי ערכיות שונה, אך עם סכום זהה של כל הערכיות. המקרה הזה נקרא הטרווולנטיתאיזומורפיזם. כזה, למשל, הוא האיזומורפיזם בסדרת הפלגיוקלאזים, כאשר ניתן להחליף את קבוצת NaAlSi 3 O 8 ביחסים המגוונים ביותר בקבוצת CaAl 2 Si 2 O 8 עם היווצרות גבישים מאותה מעמד סימטריה. למעשה, כאן יש לנו את ההחלפה של Na 1+ Si 4+ עם Ca 2+ Al 3+.
באיזומורפיזם הטרוולנטי, הגדלים של היחידות המבניות המחליפות זו את זו (אטומים, יונים, קומפלקסים יוניים) עדיין ממלאים תפקיד מכריע: הם חייבים להיות פחות או יותר זהים. ההבדל ברדיוסים של רכיבים המחליפים זה את זה, כפי שמראה השוואות, בדרך כלל אינו עולה על 15% מהרדיוס הקטן יותר.
כידוע, הרדיוסים היוניים בקבוצות האנכיות של המערכת המחזורית של היסודות גדלים עם עלייה במספר הסידורי וירידה בכיוון האופקי עם עלייה במספר הקבוצה (כלומר, עם עלייה בערכיות). על בסיס זה, A. E. Fersman גזר את החוק של שורות אלכסוניות של יונים איזומורפיים במערכת היסודות המחזורית, אשר תקף עבור הצד השמאלי שלה. סדרות איזומורפיזם יונים ההטרוולנטיים הבאים מתוארות (רדיוסים יוניים באנגסטרום מוצגים בסוגריים):
- Li 1+ (0.69) -Mg 2+ (0.75) -Sc 3+ (0.81) -Zr 4+ (0.82)
- Na 1+ (0.98) -Ca 2+ (1.01) -Y 3+ (1.06)
- K 1+ (1.33) -Sp 2+ (1.27)
- Rb 1+ (1.48)-Ba 2+ (1.36)
- Al 3+ (0.57) -Ti 4+ (0.65) -Nb 5+ (0.70)
ואכן, בתרכובות טבעיות, אנו רואים לעתים קרובות שמינרלים של ליתיום, למשל, מכילים זיהומי מגנזיום איזומורפיים, מינרלים מגנזיום - זיהומי סקנדיום, מינרלים נתרן - זיהומי סידן, מינרלים סידן - זיהומי איטריום וכו'.
בנוסף, באניונים מורכבים, ניתן להחליף את 4- יונים ב-5-, 3- ו-2- יונים, בעלי גדלים זהים או דומים. על דוגמאות למה שנאמר, נעצור יותר מפעם אחת בתיאור מינרלים.
מנקודת מבט גנטית, חשוב להבחין בין שני סוגים של תמיסות מוצקות:
- פתרונות מוצקים אמיתיים ו
- פתרונות פסאודו מוצקים.
פתרונות מוצקים אמיתיים, או כפי שהם נקראים אחרת, תערובות איזומורפיות *, הן תערובות הומוגניות לחלוטין במבנה הגבישי בכל פרופורציה של שניים או יותר חומרים שאינם יוצרים תרכובות כימיות. דוגמאות לכך הן תמיסות מוצקות של זהב וכסף, טונגסטאטים מנגן וברזל, פלגיוקלס וכו'.
* (בספרות יש גם מילה נרדפת ל"גבישים מעורבים" (בתרגום מילולי מ שפה גרמנית). הכותרת לא ממש נכונה.)
התכונות הפיזיקליות והכימיות של תמיסות מוצקות הן תוספות*, כלומר, הן משתנות בהדרגה ובאופן קבוע עם עלייה בתכולת הרכיב השני. אלה הם, למשל, השינוי בנקודת ההיתוך, משקל סגולי, מדדי שבירה, רפלקטיביות, מוליכות חשמלית וכו'. שינויים בכל המאפיינים הללו בתרשימים מתבטאים בקווים ישרים (עבור משקל סגולי) או עקומות מתעקלות בצורה חלקה (נקודות התכה, תכונות אופטיות וכו'). עקומות אלה עבור סדרות איזומורפיות אופייניות כל כך, שלפי מכלול התכונות הנחקרות של כל נתון סוג מינרלניתן להשתמש בהם כדי לקבוע את הרכבו מבלי להזדקק לניתוח כימי. לדוגמה, לא קשה לקבוע את הרכב הפלגיוקלאז בדרך זו באמצעות דיאגרמות מיוחדות על ידי לימוד התכונות האופטיות שלו בחתכים דקים תחת מיקרוסקופ.
* ("אדו" - הוסף)
ישנם שני סוגים של פתרונות מוצקים אמיתיים:
- א) תמיסות מוצקות חלופיות (או תמיסות מהסוג הראשון) ו
- ב) תמיסות מוצקות ביניים (או תמיסות מהסוג השני).
א) תמיסות מוצקות חלופיות אופייניות במיוחד למתכות ותרכובות יוניות. המהות שלהם מסתכמת בעובדה שבתרכובות בעלות סריגי גביש בנויים באופן דומה, אטומים או יונים של תרכובת אחת מוחלפים באחרים (כלומר, הם תופסים את מקומם של אחרים). מדובר, למשל, בסדרות איזומורפיות: ZnCO 3 -FeCO 3, MnWO 4 -FeWO 4 וכו'.
ב) תמיסות מוצקות ביניים מתאפיינות בכך שהרכיב השני ממוקם רק בחלל חללים, כלומר במרווחים בין האטומים או היונים המרכיבים את סריג הגביש של הרכיב הראשון. פתרון מוצק מסוג זה יכול להתרחש רק בתנאי שגדלים של האטומים (יונים) של שני המרכיבים שונים זה מזה באופן חד. הדוגמה האופיינית ביותר לפתרון מוצק מסוג זה היא תמיסה של פחמן בברזל, שנוצרת בקלות בטמפרטורות גבוהות ומתפרקת לברזל ולקרביד ברזל (Fe 3 C) עם קירור איטי.
בנוסחאות הכימיות של תמיסות מוצקות, אטומים איזומורפיים או יונים מוצבים בסוגריים, מופרדים זה מזה בפסיקים ומסודרים בסדר יורד של התוכן: (Au,Ag), (Zn,Fe)S, (Zn,Fe)CO 3, (Fe ,Mn)WO 4 וכו'. זיהומים איזומורפיים קלים אינם מצוינים כלל בנוסחה, או מוזנים באותיות קטנות יותר. אם אחד המרכיבים במלח כפול מכיל זיהומים איזומורפיים, הנוסחה מוצגת באופן הבא: Ca(Mg,Fe) 2 .
פתרונות פסאודו מוצקיםהם נבדלים מהאמיתיים בכך שהם מכילים זיהומים מפוזרים דק של חומרים זרים, שלא ניתן להסביר את נוכחותם על בסיס חוקי הכימיה של הגבישים. דוגמאות לתמיסות פסאודו מוצקות הן סוליות קריסטל (עמ' 39), בפרט, מינרלים שקופים צבעוניים כמו רוז קוורץ, קלציט אדום, ספלריט שחור וכו', שנראים הומוגניים לחלוטין (פיגמנט הצביעה מופץ כל כך דק ב- אוֹתָם).
חיבורי מים. ראשית עלינו להעיר את ההערה החשובה הבאה. תרכובות מימיות צריכות לכלול רק את אלו המכילות בהרכבן תרכובות ניטרליות חשמלית. מולקולות מים. בעבר, במסווה של תרכובות מים, נחשבו גם מינרלים המכילים אניוני הידרוקסיל [OH] 1-. עם זאת, בין מולקולת H 2 O ליון [OH] 1- בעל המטען השלילי, יש כמובן הבדל מהותי שיש לו השפעה משמעותית מאוד על הפיזיקלי תכונות כימיותמינרלים. הידרוקסיל, כיון, מסוגל להחליף אניונים כגון F 1-, Cl 1- בתרכובות והוא מוחזק בחוזקה בסריגי גביש. למולקולת H 2 O אין תכונה זו, ובהיותה קשורה בצורה חלשה בסריג, היא מוסרת בקלות בעת חימום. העובדה שהידרוקסיל, עם הסתיידות מינרלים המכילים אותו, היוצאים מסבכת הגביש, מסוגל להפוך לאדי מים, בשום פנים ואופן לא יכולה לשמש בסיס לזיהויו עם מולקולת H 2 O. לכן, חשוב מאוד מציינים בנפרד את נוכחותם של הידרוקסיל ומים בנוסחאות הכימיות של מינרלים. מנקודת מבט זו, למשל, מלכיט - Cu 2 2 אינו מים, אלא פחמת הנחושת הנידחת העיקרית, אם כי בניתוח כימי ההידרוקסיל נקבע בצורה של H 2 O. כך גם לגבי מינרלים שהם מלחים חומציים , שבין הקטיונים יש מימן.
בהתאם לאופן שבו המים נשמרים במינרלים, ישנם:
- התגבשות או מים קשורים הכלולים בסריגי הגביש של מינרלים, ו
- מים חופשיים, שאינם מעורבים במבנה החומר הגבישי עצמו
מים קשוריםמשתתף בסריג בצורה של מולקולות H 2 O, תופס בו מקומות מוגדרים בהחלט. מספר מולקולות המים הוא ביחסים פשוטים לשאר מרכיבי התרכובת. להלן דוגמאות: Na 2 CO 3 10H 2 O (סודה), CaSO 4 2H 2 O (גבס), Ni 3 2 8H 2 O (annabergite), Al 2 3 5H 2 O (wavellite), וכו'. -המכונים הידרטים גבישיים, שעל פי ורנר יש להתייחס אליהם כ"תרכובות מורכבות", כלומר כאלו שבהן מולקולות מים כיחידות מבניות ממוקמות בתיאום מסוים סביב יונים מסוימים, וכך נוצרות מעין יונים מורכבים.
אז, במבנה הגבישי של תרכובת NiSO 4 6H 2 O, מחקרי רנטגן קבעו ששש מולקולות דיפול H 2 O מקיפות ישירות את קטיון Ni 2+, ברור שמכוונות בצורה מסוימת ביחס לקטיון (שני H 1+ פרוטונים לפריפריה של היון המורכב). מכיוון שמולקולת H 2 O עצמה היא ניטרלית מבחינה חשמלית, קטיון 2+ המולחים שומר על המטען של Ni 2+. בגלל זה נוסחה כימיתחיבורים צריכים להיות כתובים כך:
נתעכב על שאלת הסיבה להידרציה של יונים בסריגי גביש בהמשך (במבוא למלחי חמצן). כאן נוכל רק לציין שהצורך בהידרציה של היונים מוצדק בקפדנות קריסטלוכימית; ליצירת סריג קריסטל יציבים מאניונים גדולים כמו 2-, הקטיונים Ni 2+ הנמצאים בתמיסה קטנים מדי, ולכן יש רצון להגדיל את נפחם מבלי לשנות את המטען. מובן מאליו שיצירת הידרטים גבישיים יכולה להתרחש רק במדיה עשירה במים, ובשעה טמפרטורות נמוכות.
בעת חימום, הידרטים גבישיים מתייבשים בקלות, אם לא לגמרי בבת אחת, אז בפתאומיות, ומאבדים מעת לעת חלק ממולקולות המים. במקרה זה, הסידור מחדש של הסריג מתרחש תוך שימור של יחסים רציונליים בין מספר מולקולות H 2 O לבין התרכובת הראשית. לדוגמה, כלקנתיט (CuSO 4 5H 2 O) במהלך התייבשות מלאכותית יוצר תחילה CuSO 4 3H 2 O, לאחר מכן CuSO 4 H 2 O ולבסוף CuSO 4. במקביל, גם תכונות פיזיקליות כמו מדדי שבירה, משקל סגולי וכו' משתנות באופן פתאומי. תרכובות שונותמים מוסרים בטמפרטורות שונות: חלקם מאבדים אותם בטמפרטורת החדר (נחושת רב-הידרומית וברזל סולפטים), אחרים בטמפרטורות גבוהות יותר ואפילו בטמפרטורות מעל 100 מעלות.
מים חינם, הקיים במסות מינרלים, מאופיין בכך שהוא אינו משתתף ישירות במבנה של סריג הקריסטל של מינרלים. כאשר מחומם, הוא משתחרר בהדרגה. ישנם שלושה סוגים של מים חינם:
- א) זאוליט
- ב) קולואידים ו
- ג) היגרוסקופי
מי זאוליט קיבלו את שמו מהשם הכללי של קבוצה מיוחדת של מינרלים - זאוליטים, שבהם תכונות נוכחותם באות לידי ביטוי בצורה הברורה ביותר. נקבע כי מולקולות מים בקבוצת מינרלים זו אינן תופסות מיקום מוגדר בקפדנות בסריג הגביש, אלא נמצאות רק בחללים חופשיים בו (לאורך תעלות, בחללים בין-שכבתיים וכו'). לכן, "המסיסות" המים בהם מוגבלת משמעותית. מעניין שכמות המים בהם יכולה להשתנות מבלי להפר את ההומוגניות הגבישית של החומר עם שינוי הדרגתי בתכונות הפיזיקליות: מידת השקיפות, מדדי השבירה, משקל סגולי וכו'. זה מצביע על כך שהמים הם, כביכול. , במצב של תמיסה מוצקה. כאשר מחומם, הוא משתחרר בטווח של 80-400 מעלות. זה מוזר שזאוליטים שהתייבשו על ידי חימום זהיר מסוגלים שוב לספוג מים עם שחזור התכונות הפיזיקליות הקודמות שלהם.
מים קולואידים, כפי שהשם עצמו מעיד, נפוצים בהידרוג'לים, שם הם מוחזקים על פני השטח של שלבים מפוזרים (עמ' 37) על ידי כוחות קשירה חלשים מאוד. הם בעצם מי ספיחה, ונוכחותם אינה תלויה בסריג הסופח (הסופח עצמו, כמובן, עשוי להכיל מים הקשורים גבישיים כימית). דוגמה לכך היא אופל (סיליקה הידרוג'ל) - SiO 2 aq (aq היא שתי האותיות הראשונות של המילה הלטינית "אקווה" - מים). ייעוד זה של מים קולואידים, שאומץ על ידי כמה מחברים, צריך להיות מוכר כרציונלי.
מים היגרוסקופיים (נימיים) מוחזקים בסדקים דקים, נקבוביות ומסות אבקתיות על ידי כוחות מתח פני השטח. לרוב, הוא מוסר בקלות כאשר מחומם ל-100-110 מעלות. לא ניתן לשרטט גבול חד בין מים נימיים וקולואידים.
כדי לקבוע את ההרכב הכימי של המינרל, מתבצעת הניתוח הכימי שלו ונקבעת הנוסחה הכימית של המינרל. נוסחאות יכולות להיות אמפיריות, להראות רק את ההרכב הכימי, ומבניות, לתת מושג על הסידור המרחבי של אטומים במינרל והיחס שלהם זה לזה. עבור כמה מינרלים, נוסחאות מבניות טרם הוקמו. אבל הודות לשיטות מחקר בקרני רנטגן, במקרים רבים ניתן היה לקבוע את הקשר של אטומים במבני הגביש של מינרלים. שאלות אלו של הקשר של כימיה עם מבנה החומר ותכונותיו עוסקות בכימיה הגבישית.
במינרלים חשוב לזהות קטיונים ומתחמים אניונים המאפיינים את סוגי מבני הגביש. בעת כתיבת נוסחאות מינרלים, קומפלקסים אניונים מופרדים מקטיונים על ידי סוגריים מרובעים, למשל, Siderit Fe. יש לזכור שהנוסחאות האמפיריות של מינרלים אינן משקפות את תכונות המבנה הפנימי שלהם ובמינרלוגיה הן מוחלפות כיום ב נוסחאות מבניות. אז, הנוסחה האמפירית של המינרל מוסקוביט היא H 2 KAl 3 Si 3 O 12, והנוסחה המבנית היא KAl 2 (OH,F) 2. האחרון מראה שיש קומפלקס אניוני מורכב במבנה של מוסקוביט ושהמים במוסקוביט אינם בצורת H 2 O, אלא בצורה של הידרוקסיל (OH) - , וניתן להחליף את ההידרוקסיל הזה בתורו על ידי ו - .
במינרלוגיה, מינרלים מימיים ומינרלים (סולפטים, פוספטים, קרבונטים וכו') מובחנים לעתים קרובות. מינרלים של מים כוללים את אותם מינרלים המכילים מולקולות מים ניטרליות מבחינה חשמלית. מים בהרכב של מינרלים יכולים להיות קשורים וחופשיים. מים קשורים, או התגבשות, נכנסים לסריג הגבישי של מינרלים, תופסים בו מקומות מסוימים. דוגמאות לכך הן קרבונטים וסולפטים מסוימים, כגון גבס. מים חופשיים אינם משתתפים במבנה של סריג הקריסטל של מינרלים; הכמות שלהם יכולה להיות שונה, תלוי, למשל, בטמפרטורה. דוגמאות למים חופשיים הם מי זאוליט. וכמובן, כל המים ההיגרוסקופיים, המוחזקים בסדקים מיקרוסקופיים במינרלים ובסלעים על ידי כוחות מתח פני השטח, הם גם הם חופשיים. הוא מוסר על ידי חימום ל-110 מעלות צלזיוס. מינרלים המכילים הידרוקסיל במובן המחמיר אינם יכולים להיקרא מינרלים מים. קיים הבדל מהותי בין מולקולת המים הנייטרלית החשמלית H 2 O לבין יון ההידרוקסיל הטעון שלילי (HO). הידרוקסיל (HO) - יכול להחליף יונים כמו Cl - ו- Fe - במינרלים, הוא מוחזק בחוזקה בסריגי גביש, ולמולקולות מים אין תכונות אלו.
משימה 3.חקר צורות ההפרשות הטבעיות של מינרלים.
מורפולוגיה של מינרלים ואגרגטים. תְאוּמִים
גידולים הדדיים של גבישים
עבור חלק מהמינרלים (ספדי פלד, רוטיל, קסטיריט, אראגוניט, צינבר ורבים אחרים), אופיינית היווצרותם של לא רק גבישים בודדים, אלא גם גידולי התאומים שלהם - תאומים. בחיבורים אמיתיים, לא אקראיים, פרטים גדלים יחד לאורך אותן רשתות שטוחות של הרשתות המרחביות שלהם. מבחינה גיאומטרית, ניתן לשלב אנשים בדאבל מנטלית זה עם זה על ידי השתקפות במישור הסימטריה או על ידי סיבוב סביב הציר ל 2. כפולים יכולים להיות מורכבים מזוג גבישים (פשוטים) או ממספר פרטים חוזרים. תכונה אופייניתתאומי פן הם הזוויות הנכנסות בין הפנים; זוויות כאלה אינן קיימות על גבישים בודדים שפותחו באופן אידיאלי. יש צורך להבחין בין תאומי היתוך לתאומי נביטה. בראשון, פרטים מתוחמים לאורך המישור, נראה שהם נמצאים בקשר זה עם זה. שנית, הגבישים, כביכול, מצמיחים זה את זה או חודרים זה לזה דרך ודרך, נוגעים לאורך משטח מתפתל (מדרגתי) מורכב. תאומים נוצרים מסיבות שונות. בפתרון, כאשר הגבישים עדיין במצב גרעין ותחת פעולת כוחות מסוימים מסתובבים זה לזה. במהלך המעבר משינוי פולימורפי אחד לאחר. תחת השפעות מכניות על גידול גבישים.
גבישים כוזבים–פסאודומורפים
פסאודומורפוזה היא גביש או גרגר של מינרל המוחלפים מבלי לשנות את צורתו במינרל אחר או בתערובת של מינרלים, ומכאן השם שגוי (פסאודו) צורה (מורף). תצורות אלה שומרות לעתים קרובות אפילו את הפרטים הקטנים ביותר של פני השטח של הגבישים והגרגרים המקוריים (איור 27).
אורז. 27. קוורץ על ידי ורידי אסבסט:
מה שנקרא "עין הנמר" - צהוב ו"הוקי" - כחול
לפי פסאודומורפוזות, אפשר לשפוט את התגובות הכימיות של היווצרות מינרלים, שכן גם המינרל המקורי (הדגן) וגם התוצר הסופי של השינוי נראים בו זמנית. בתנאי פני השטח, גבישי פיריט מוחלפים בלימוניט - מסה אבקתית חומה צפופה, תערובת של הידרוקסידים Fe 3+ שונים (איור 28).

אורז. 28. פסאודומורף לימוניט לאחר בטון פיריט, 4 ס"מ,
"מדבר לבן", מצרים
דרך נוספת ליצור פסאודומורפים היא טרנספורמציות פולימורפיות של חומרים עם שינויים בטמפרטורה ובלחץ, הם נקראים פרמורפוזות. לדוגמה, פרמורפוזות של אלפא קוורץ על ידי בטא קוורץ ( טטרנספורמציה 575 0 С ב-100 kPa). כמו כן יש טביעות פסאודומורפים חלולים במסת הסלע של גבישים של מינרלים מומסים, שמקומם נותר פנוי (איור 29).

אורז. 29. קוורץ של פלואוריט
החלפה פסאודומורפית חלקית של פני השטח עם עכירות לאחר מכן של האזורים המוחלפים עם גבישי קוורץ. הפלואוריט עצמו הומס לאחר מכן, והותיר אחריו חללים מרכזיים בצורת קובייה שלילית. מדגם 9 ס"מ, Kadamjai, קירגיזסטן.
אגרגטים מינרלים
בטבע, גבישים בודדים בעלי פנים טובים הם נדירים יחסית, לעתים קרובות יותר מינרלים יוצרים אשכולות שונים - אגרגטים. במינרלוגיה, הם מחולקים בדרך כלל לפי מורפולוגיה: אדמתי, גרגירי, צפוף, אגרגטים; דרוזים, מברשות, הפרשות, קונקרטיות, אוליטים, ספירוליטים, אגרגטים סינטרים, דנדריטים, פשיטות ומריחות.
אגרגטים אדמתיים הם אגרגטים דגנים של גרגירים מינרלים עדינים מאוד. סוג זה של אגרגטים מיוצג בצורה הרחבה ביותר בקרום כדור הארץ. אגרגטים גרגירים הם מסות רופפות או רצופות של גרגירים שצומחו באקראי של מינרל אחד (מונומינרלי) או כמה (פולימינרלי). כל גרגר הוא גביש לא חתוך ולא מעוצב שגדל בתנאים צפופים. בהתאם לגודל הגרגירים, הם מחולקים לגרגרים גסים (>5 מ"מ), בינוניים (1-5 מ"מ), גרגרים עדינים (<1 мм). Характерный пример – полнокристаллические магматические породы (граниты и пр.).
אורז. 30. צבר גרניט אמזוניט בינוני
בין המינרלים הוא מבחין בשלוש קבוצות בעלות מראה אופייני של גבישים:
- איזומטרי, מפותח באותה מידה בכל שלושת הכיוונים - מגנטיט, פיריט, נופך;
- מוארך בכיוון אחד, מנסרתי, עמודים, אצילי וקורן, - בריט, קוורץ;
- מוארך לשני כיוונים, טבלאי, למלרי, עלים וקשקשי, - כלוריט וכו'.
בהתאם להופעת הגבישים נוצרים סוגים שונים של אגרגטים מינרלים: עלים (a), קשקשים (b), סיביים (c) ו-(ד), קורנים רדיאליים (e), עמודים (f) (איור 31). ).
א  ב
ב 
ב  G
G 
ד  ה
ה 
אורז. 31. אגרגט עלים - טלק ( א), צבר קשקשי בינוני - פרגוניט ( ב), צבר ארוך סיבים - אסבסט כריסוטי ( ב), צבר קורן רדיאלי - אגירין (ד), צבר עמודים - קיאניט (ה), צבר סיבי - סלניט גבס (ו)
עמודים מקבילים (איור 31, ה) ואגרגטים סיביים (איור 31 ב, G) נוצרים בדרך כלל בסדקים. אלה הם ורידים של גבס משיי, אסבסט סרפנטין, קלציט עמודים. במקרים מסוימים, אגרגטים אלו מתגבשים בסדקים פתוחים: ראשית, דרוזים צומחים על הקירות לפי עקרון הבחירה הגיאומטרית; צומחים זה לקראת זה, הם נסגרים ויוצרים אגרגטים עמודים או סיביים מקבילים. באחרים נוצרים אגרגטים כאלה בפתיחה הדרגתית של סדקים, כאשר קצב הפתיחה קטן או שווה לקצב הצמיחה של פרטים. ראשית, הסדק מתמלא בצבר מינרלים גרגירי בצורה של וריד דק מתמשך. לאחר מכן, כשהגרגרים נפתחים, נחים זה כנגד זה, הם יכולים לגדול רק לאחר הקירות המתרחבים של הסדק. הם נמתחים בהדרגה באופן נורמלי אל הקירות, ויוצרים מצרף עמודי מקביל או סיבי.
אגרגטים מסונטרים
צורות סינטר של תצורות מינרלים מתעוררות עקב פתרונות קולואידים - ג'לים. פתרונות קולואידים נודדים לאט, נופלים לחללים, עוטפים את קירותיהם, מאבדים בהדרגה מים ומתעבים. כתוצאה מכך נוצרות צורות שונות של אגרגטים:
- נטיפים - תלויים בהשפעת כוח הכבידה מהחלקים העליונים של החללים;
- סטלגמיטים - נוצרים בחלקים התחתונים של החללים עקב נפילה של טיפות;
- אגרגטים בצורת כליה - הנפוצים ביותר בין צורות סינטר, מתרחשים בתנאי פני השטח.
הגדלים של תצורות כאלה הם שונים: מ-microscopic to incrustations דמויי עמודים גדולים במערות. ניתן למצוא מגוון מינרלים בצורות סינטר: הידרוקסידים של ברזל ומנגן, אופל, מלכיט, גבס, אראגוניט, קלציט ועוד. תצורות סינטר בחתך בעלות מבנה אזורי-קונצנטרי.
דרוסים (מברשות) הם קבוצות של גבישים שצמחו בניצב או כמעט בניצב לפני השטח של סדקים, דפנות וריד או חלל בסלע. ראשית, גבישים בודדים גדלים, גדלים, הם באים במגע זה עם זה, נחים זה כנגד זה ומונעים מעצמם לצמוח. רק אותם גבישים ממשיכים לצמוח, שווקטור הצמיחה שלהם מכוון למרחב פנוי, כלומר. נורמלי למשטח הסדק. דוגמאות של דרוזים מוצגות באיור. 32 או ב.
א  ב
ב 
אורז. 32. דרוז של קוורץ ( א), מברשת של גבישי אמטיסט ( ב)
הפרשות נוצרות כאשר כל חלל בסלע מתמלא בחומר מינרלי. לעתים קרובות במרכז ההפרשות דרוזן. לרוב הפרשות של כלקדוני עם דרוזן קוורץ בפנים, מוגבלות לשקדים בבזלת. הפרשות עם חללים פנימיים נקראות גיאודים (איור 33).

אורז. 33. אגת כלקדוני חום כהה עם דרוז קוורץ במרכז
בטון הוא אגרגט מינרלי כדורי (לעיתים כאילו שטוח, מעוגל לא סדיר) בעל מבנה קורן רדיאלי (איור 34). בניגוד להפרשות (גיאודים), הן גדלות סביב מרכז. במרכז הבטון יש פעמים רבות גרגר, ששימש כזרע במהלך צמיחתו. לרוב נוצרים קונקרטים בסלעי משקע נקבוביים - חולות וחרסיות. הגדלים של תצורות אלו נעים בין מילימטרים לעשרות סנטימטרים, ולעתים אף עד מטר או יותר. הם מגוונים בצורה ומבנה. קונקרטים יכולים להיות גבישיים צפופים (מקרינים או גרגירים); קריפטוקריסטלי (צור); משוחרר ואדמתי (לימוניט, ויוויאניט).
סלעי משקע מכילים לעתים קרובות קונקרטים של פיריט, מרקסיט, סיליקה (קוורץ, כלקדוני, צור), קרבונטים ופוספוריטים. גושים של פרומנגן הם בעלי עניין מדעי ומעשי; הם נוצרים בכמויות אדירות על קרקעית האוקיינוס ונחשבים למשאב חומר גלם מבטיח של העתיד.
מגוון אקזוטי של גושים בהרכב קרבונט-ארג'ילתי, המצוי רק בסלעי משקע ומאופיין בנוכחות של סדקי ייבוש רבים בתוכם, נקרא ספטריה (איור 35).
. 

אורז. 34. גוש איור. 35. ספטריה
האוליטים הם תצורות כדוריות או אליפסואידיות של סידן פחמתי, תחמוצות ברזל ומנגן, סיליקה וכו', בעלות מבנה קונצנטרי-קונצנטרי, לפעמים קורן רדיאלי (סביב הליבה המרכזית). הליבה יכולה להיות שברי קונכיות, גרגרי חול, חלוקי נחל וכו'. מינרלים כמו קלציט, אראגוניט ופירולוזיט נמצאים לרוב בצורת אוליטים.
האוליטים נוצרים במהלך שיקוע (בהשעיה, במים), במהלך דיגנזה, ובשלבים אחרים של טרנספורמציה של משקעים במהלך מחזור התמיסות בחלל החללים. לרוב, אוליטים נוצרים במעיינות חמים, באגמים קרובים לקרקעית ובסחי ים.
הם מצויים לעתים קרובות באבני גיר, עפרות ברזל, בוקסיטים (איור 36), סלעי סיליקון וכו'. גודלם של האוליטים נע בין מילימטרים למספר סנטימטרים. אווליטים גדולים מ-2-5 מ"מ נקראים פיסוליטים.

אורז. 36. בוקסיט אוליטי
ספירוליטים ואגרגטים בצורת כליה נקראים על שם המורפולוגיה שלהם. לספירוליטים יש לרוב צורה וגודל כדורי כמעט קבועים משברים עד 1-2 ס"מ או יותר. הם גדלים כמו כדורים על מינרלים אחרים ועל קירות חללים שונים בעפרות ובסלעים. ספירוליטים נוצרים או כתוצאה מגידול מפוצל של גבישים, או בהם, כמו בקונקרטיות, קיים גרגר גרעין שעליו גדל המינרל. בשל בחירה גיאומטרית או תנאים מוגבלים, גבישים יכולים לצמוח רק על ידי הקרנה ממרכז הספירוליט (איור 37).
אורז. 37. ספרוליט
אגרגטים רניפורמים מורכבים מ"ניצנים" רציפים רבים, שלכל אחד מהם, כמו ספירוליט, מבנה קורן רדיאלי (איור 38). אגרגטים רניפורמיים של גתיט HFeO 2 H 2 O ומלאכיט Cu 2 (CO 3) (OH) 2 הם בעלי מבנה אופייני במיוחד. היווצרותם התרחשה על משטח לא אחיד עקב גידול הקבוצה והבחירה הגיאומטרית של ספירוליטים; רק אותם ספירוליטים שהיו על בליטות המצע נשארו וגדלו. לרוב נוצרים אגרגטים בצורת כליה בחללים שונים באזורים קרובים לפני השטח של הרס ובלייה של עפרות וסלעים.

אורז. 38. צבר רניפורמי של המטיט קורן רדיאלי
דנדריטים הם צורות דמויות עץ הנוצרות על ידי צמיחה מהירה של גבישים בכיוונים מסוימים. הם מתרחשים על פני הסלעים לאורך סדקים דקים. דנדריטים אופייניים במיוחד לתחמוצות מנגן (איור 39).

אורז. 39. דנדריטים של תחמוצות מנגן (וורנדיט) על סיניט
מסות אדמתיות הן תצורות נסתרות-גרגיריות של גרגירי רך. הם נצפים לעתים קרובות בצורה של קרומים והצטברויות, המתרחשות לרוב במהלך בליה כימית של סלעים ועפרות. בהתאם לצבע, מסות אדמתיות נקראות מפויחות (מסות שחורות של הידרוקסיד מנגן), אוכרית (מסות צהובות-חומות של הידרוקסידי ברזל).
