Формулата на минерала, който. Химичен състав на минералите, изчисляване на формули
Всеки минерал има специфичен химичен състав. може да се състои от един химичен елемент или няколко. Ако даден минерал се състои от един химичен елемент, той се нарича самороден елемент. Например самородно, самородно сребро, самородно и т.н. Повечето минерали обаче се състоят от няколко, а понякога и от много химични елементи. Съставът на минералите обикновено се изразява под формата на химична формула или в тегловни проценти, определени чрез химичен анализ.
Например, химичен съставминералите халкопирит и аналцим могат да бъдат изразени като следните тегловни проценти на химични елементи (за първия) или оксиди (за втория):
I. (Cu - 34,9) + (Fe - 30,47) + (S - 34,6) = Сума 99,97
II. (SiO 2 - 55,12) + (Al 2 O 3 - 22,99) + (Na 2 O - 13,53) + (H 2 O - 8,27) = Общо 99,81
Формулите за тези минерали се изчисляват чрез разделяне на посочените тегловни количества на съответните атомни или молекулни тегла. В този случай се получават атомни или молекулни количества. Атомните маси на химичните елементи се вземат от таблицата на периодичната система от елементи на Д. И. Менделеев, молекулното тегло на оксида се получава чрез сумиране на атомните маси, които съставляват съответния оксид на елементите. Атомните или молекулярните количества се заменят с техните пропорционални коефициенти в получената формула. Примери за изчисляване на формулата на халкопирит и аналцим са дадени в таблица. 7.
Формулите, получени по време на изчислението и даващи представа за химичния състав на минерала, се наричат емпирични. Това са получените формули на халкопирит и аналцим - 4Si02 Al203 NagO 2H20. Емпиричната формула на аналцима, написана под формата на оксиди, не отразява връзките между химичните елементи и не казва нищо за структурата на минерала; това писане на формулата има едно предимство - по-лесно се запомня.
| Преизчисляване на данните от химичния анализ и установяване на минералната формула Таблица 7 | ||||
| Компоненти | Процент тегло | Атомни (молекулни) величини | Връзки между атомни (молекулни) количества | Име и формула на минерала |
| Cu | 34,9 | 34,9: 63,5 = 0,550 | 1 | CuFeS2 |
| Fe | 30,47 | 30,47: 55,8 = 0,546 | 1 | |
| С | 34,6 | 34,6: 32 = 1,081 | 2 | |
| SiO2 | 55,12 | 55,12: 60 = 0,919 | 4 | 4SiO2 Al2O3 Na2O 2H2O |
| Al2O3 | 22,99 | 22,99: 102 = 0,225 | 1 | |
| Na2O | 13,53 | 13,53: 62 = 0,218 | 1 | |
| H2O | 8,27 | 8,27: 18 = 0,459 | 2 | |
За редица минерали е обичайно да се пишат формули, които отразяват вида на химичното съединение и взаимните връзки между съставните химични елементи. Такива формули се наричат структурни или кристалохимични. Формулата на аналцима е Na H 2 O; е структурна. В квадратните скоби се подчертава радикалът, който представлява сложен анионен комплекс, който присъства в минерала в количество от една молекула, изписан е в края на формулата и е отделен от нея с точка. Друг пример. Емпиричната формула на мусковита е H 2 KAl 3 Si 3 O 12 , структурната формула е KAl 2 (OH, F) 2 . В тази формула сложен анионен комплекс е изолиран като радикал и присъства в минерала не под формата на H 2 O, а под формата на хидроксил (OH) - , който може да бъде заменен от друга запетая. Химическият елемент на първо място в скобите присъства в по-голямо количество. Например формулата на анкерита е Ca (Mg, Fe) 2 2 . Рентгеновият дифракционен анализ вече направи възможно установяването на структурните формули на много минерали.
ПОНЯТИЕТО ЗА МИНЕРАЛ И МИНЕРАЛОГИЯ
Минералите са природни вещества (химични съединения, по-рядко елементи) с определени химични и физични свойства. Думата "минерал" означава руден къс, парче руда.
Скалата, като гранит, също е продукт на геоложки процеси в земната кора, не може да се нарече минерал, тъй като е разнороден във физическо и химично отношение различни части. Гранитът включва както кварц със своя състав и структура, така и фелдшпат, слюда, които се различават от кварца и помежду си.
Минералогията е наука, която изучава минералите. Съвременната минералогия изучава произхода (генезиса) на минералите, моделите на тяхното разпространение в природата (парагенеза), както и условията за превръщането им в други минерали, тъй като всеки от минералите се образува и е стабилен в определен температурен диапазон, налягане и концентрация на химични елементи. Задачата на минералогията също включва изучаването на морфологията (външен вид), физични свойства, химичен състав и вътрешна структура на минералите.
Минералите са важни в националната икономика: те се използват като строителни материали, ценни и полускъпоценни камъни, руди на черни, цветни и редки метали, селскостопански руди и др.
Търсенето им е рационално само въз основа на познаването на закономерностите на образуване на минералите в определена природна среда.
Минералогията е тясно свързана с целия цикъл на геоложките науки: геология, петрография и геохимия, изследване на минералите. Минералогията е свързана и с цикъла на физико-химичните науки: химия, физика, кристалография.
Земната кора е изградена от минерали. Известни са около 2000 от тях. Повечето отминералите в природата са в твърдо състояние; течни минерали (живак, вода, нефт и др.) и газообразни ( въглероден двуокис, запалими газове, сероводород, серен диоксид и др.).
Хората отдавна са се научили да създават синтетични продукти, които са сходни по свойства, състав и структура с минералите. Те се наричат изкуствени минерали (например кварц, корунд, слюда и др.).
Имената на минералите се дават по характерни физични свойства (например магнетит), по химичен състав (серни пирити) или по мястото на първо откритие (Лабрадор, по името на полуостров Лабрадор в Северна Америка), в чест на учени или общественици (биотит - черна слюда, в чест на физика Биот). Повечето минерали имат няколко имена.
^
ХИМИЧЕН СЪСТАВ И ФОРМУЛА НА МИНЕРАЛИ
Съставът на минерала се определя чрез химичен анализ в лаборатория. Първо, съдържанието на оксиди или отделни елементи се определя като процент, след което получените данни се изразяват чрез химичната формула на минерала.
Например химическият анализ на меден пирит (халкопирит) дава следния състав: Fe = 30,27%; Cu = 34,98%; S = 35,75%.
За да се определи химическата формула, е необходимо числата, получени по време на анализа, да се разделят на съответните атомни или молекулни тегла. След това атомните или молекулярните количества на елементите или оксидите се сравняват един с друг и се намират техните множество съотношения. Те служат като коефициенти в химичната формула на минерала (табл. 3).
Таблица 3
Пример за определяне на формулата на халкопирит
| Химични елементи | Количество вещество, % | Атомни количества | Съотношението между атомните количества | Формула |
| Fe | 30,27 | 1 | CuFeS 2 |
|
| Cu | 34,98 | 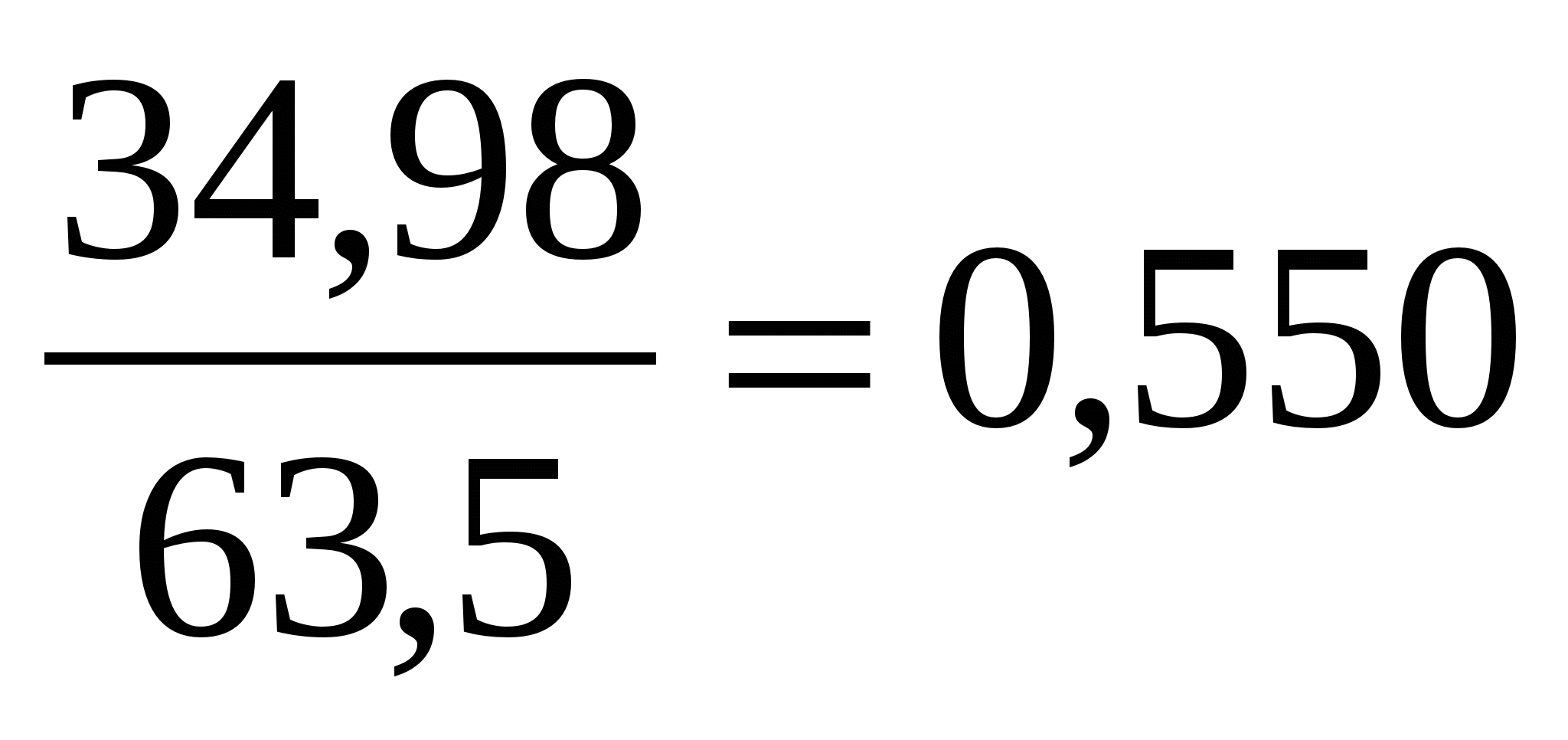 | 1 |
|
| С | 35,75 |  | 2 |
Формулата на халкопирита изразява неговия количествен състав, но не дава представа за комбинациите и начините на свързване между елементите. Коефициентите в химическата формула показват само връзката между елементите, които съставят този минерал.
Наред с емпиричните химични формули се използват и структурни формули, които дават представа не само за химичния състав, но и за пространственото положение
атоми в минерал и техните връзки помежду си. Например, емпиричната формула на минерала малахит е H 2 Cu 2 CO 5, а структурната формула, показана на равнината:
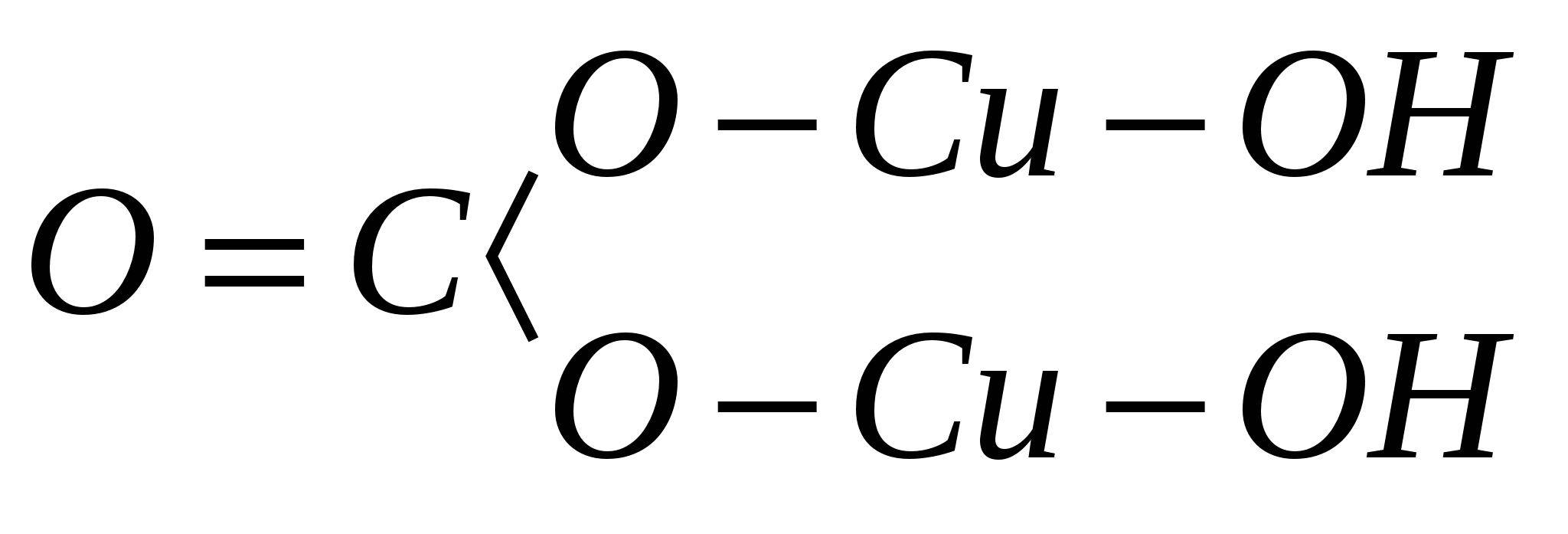
С оглед на гореизложеното горната формула за минерала малахит може да бъде записана в следната форма: Cu 2 (OH) 2 CO 3. От тази формула, базирана на структурния принцип, следва, че водата е здраво свързана с медта не под формата на H 2 O, а под формата на хидроксил (OH) 1-.
Рентгеновият метод позволява да се разкрият връзките между атомите в кристалните структури на минералите, а понякога и местоположението на последните в пространството. Науката кристалохимия се занимава с връзката между химията и структурата на веществото и неговите свойства.
В момента има много начини за писане на химичните формули на минералите, в зависимост от това какво точно искат да предадат с формулата. Например, структурната формула на ортоклаза K[(AlSi 3)O 8 ] характеризира вида на химичното съединение и взаимните връзки между отделните елементи. За да се отрази качественият състав на най-важните компоненти (елементи) и техните количествени съотношения, формулата на ортоклаза трябва да бъде представена под формата на оксиди K 2 O A1 2 O 3 -6Si0 2.
Химическият състав на повечето минерали не може да бъде точно изразен с формула. Зависи от различни механични примеси в минералите и от способността на някои съединения да образуват изоморфни смеси или твърди разтвори.
Примесите могат да бъдат или механични, груби, лесно отделящи се, или много фини, отделящи се много трудно. Появата на примеси се дължи на улавянето на чужди вещества от растящия минерал. Наличието на обикновени груби примеси не влияе на формулата на минерала.
Изоморфизмът (от гръцки "isos" - равен и "morphe" - форма) е способността на подобни по химичен състав и кристалографски свойства вещества да дават смесени кристали, т.е. изграждат обща кристална решетка по време на кристализация от стопилки или разтвори. Такива кристали се наричат изоморфни смеси. Имат променлив състав; иначе се наричат твърди разтвори.
От гледна точка на химията и структурата на кристалната решетка се разграничават два основни вида изоморфизъм: изовалентен и хетеровалентен.
При изовалентен изоморфизъм взаимно заместващите йони имат еднаква валентност, в кристалната решетка частиците с еднаква валентност се заменят - един йон с друг. Това е най-простият случай на образуване на смесени кристали. Химичните формули на изоморфните вещества в този случай са напълно сходни, различавайки се само в един йон, обикновено катион, както например в оливините. Оливините, кристализиращи в ромбичната система, са изоморфна смес от две вещества: форстерит Mg 2 и фаялит Fe 2, които също се срещат като независими минерали (също ромбична система); формулата на оливин е: (Mg, Fe) 2 . Запетаята между Mg 2+ и Fe 2+ йони в тази формула означава, че те могат да се заменят взаимно във всяко количество, образувайки непрекъсната серия от съединения с междинен състав. Доминиращият елемент обикновено се поставя на първо място.
Хетеровалентният изоморфизъм е по-сложен: в кристалната решетка йони с различна валентност се заместват, но електростатичният баланс се възстановява, така че сумата от валентностите на заместващите двойки е равна. Класически пример за такова сложно заместване са минералите от групата на фелдшпата – плагиоклазите. Плагиоклазите са непрекъсната изоморфна серия от минерали, кристализиращи в триклинна система, където двойка Ca 2+ A1 3+ йони е заменена с двойка Na + Si 4+. Крайните членове на тази серия - анортит Ca [(A1 2 Si 2)O 8] и албит Na [(A151 3)O 8] - също се срещат като независими минерали. В този случай има еднаква обща валентност на заместващите групи (5 и 5); когато NaSi се извади от формулата на албита и CaA1 от формулата на анортита, остатъкът е еднакъв и за двете формули - AlSi 2 O 8 .
В съответствие с промяната в състава се променят и физичните свойства на изоморфните вещества. Например, оптичните свойства на плагиоклазите се променят, което е основата за тяхната диагностика по време на кристалооптичното изследване. В оливините цветът на минерала се променя от зелен на черен, а точката на топене намалява с увеличаване на съдържанието на фаялит.
Според степента на съвършенство на изоморфните замествания могат да се разграничат два случая. В първия случай замяната на един елемент с друг може да бъде до 100% - това е перфектен или пълен изоморфизъм (оливини, плагиоклази). Във втория случай заместването може да бъде частично - от стотни до няколко процента. Това е несъвършен или ограничен изоморфизъм. И така, калцит Ca [CO 3 ] и магнезит Mg [CO 3 ] дават само едно съединение с междинен състав - доломит CaMg [CO 3 ] 2 . Липсата на запетая между Ca и Mg във формулата на доломита показва, че тук имаме химично съединение с определен състав, а не изоморфна смес.
Елементите, които могат да се заменят един друг във възлите на кристалната решетка (заемат една и съща позиция в нея), без да нарушават нейната структура, се наричат изоморфни един с друг и принадлежат към една и съща изоморфна серия. Концепцията за изоморфни серии от елементи, свързани с периодичната система на Менделеев, е разработена от академик В. И. Вернадски. В различните термодинамични обвивки на земната кора тези изоморфни серии са различни, т.е. промяна под въздействието на температура и налягане. Защо тогава атомите или йоните на даден елемент могат да заменят атоми (йони) само на някои, а не на всички елементи в кристалната решетка? За да разберете това, опитайте се да си представите кристалната решетка не като система от точки, разделени от големи празни празнини (както обикновено се изобразява пространствена решетка), а като система от докосващи се топки. Всяка топка е сферата на действие на атом (йон), т.е. пространство, в което, в съответствие със законите на взаимодействие на електрическите заряди, други атоми (йони), заобиколени от техните атомни (йонни) сфери, не могат да проникнат.
По този начин разстоянията между определени атоми (йони) на решетката при определени условия на температура и налягане са строго постоянни и се определят от законите на електростатиката. Радиусите на сферите на действие на атомите (йоните), наречени атомни (йонни) радиуси, също са постоянни. (Р аз ) 1 .
Измерването на атомните и йонните радиуси показа, че само онези елементи, чиито атомни (йонни) радиуси са близки един до друг, са изоморфни един на друг. Разликата в размера на радиусите на взаимно заместващите йони не трябва да надвишава 15% от радиуса на по-малкия от йоните.
Нека обясним казаното с примери. Известна е непрекъсната изоморфна серия за карбонати на магнезит Mg [CO 3 ] и сидерит Fe [C0 3 ] поради близостта на атомните (йонни) радиуси на магнезий и двувалентно желязо: Р аз Mg2+ =0.74A; Р аз Re 2+ =0.80A. Членовете на тази серия могат да бъдат изразени с формулата (Mg, Fe) [CO 3 ] или (Fe, Mg) [CO 3 ]; тук запетаята показва, че Mg и Fe йоните се държат като атоми на един и същи елемент. Но за халит NaCl и силвит KS1, които кристализират в кубичната сингония, с аналогията на химичния състав не се наблюдават изоморфни отношения (при обикновена температура), тъй като размерите на техните йонни радиуси са много различни ( Р аз Ma + = 0,98 Å, и Р азК+ = 1,33 Å).
Феноменът на изоморфните замествания не остава непроменен при различни външни условия. При високи температури заместването протича по-лесно и много вещества, които не са изоморфни при обикновени температури, стават изоморфни при високи температури. Например алкална фелдшпати, ортоклази K [(А1Si 3)О 8 ] и албит Na [(А1Si 3)О 8 ] при кристализация от магма образуват непрекъсната изоморфна серия (К, Na) [(А1Si 3)0 8 ], но след това, тъй като температурата намалява, тази изоморфна смес отново се разлага в твърдо състояние на два независими минерала: един с преобладаващо съдържание на калий - ортоклаз и другият с преобладаващо съдържание на натрий - албит. Това явление се нарича разлагане на твърди разтвори.
1 Йонни (атомни) радиуси се измерват в ангстрьоми (Å); 1 Å = 10-8 см.
Повечето минерали съдържат изоморфни примеси в различни количества. Най-важните и най-често срещаните групи силикати (оливин, пироксени, амфиболи, фелдшпати) са изоморфни смеси.
Изоморфизмът помага да се разберат причините за множество асоциации на елементи в земната кора и дава възможност да се предвиди в редица случаи наличието на определени търговски ценни редки (разпръснати) елементи в много широко разпространени минерали. Така например германий се маскира от силиций, цезий, рубидий - от калий и т.н.
Полиморфизмът (от гръцки "poly" - много и "morphe" - форма), или мултиформност, е способността на веществото да кристализира с еднакъв химичен състав в различни структури, свързани с различни видовесиметрия или сингония. Отделни разновидности на едно и също вещество, имащи различна структура, се различават по своите свойства. Те са минерали - полиморфни разновидности (модификации) на дадено вещество. Появата на такива се обяснява с различните физикохимични условия на образуването им (температура, налягане) и характера на средата. На полиморфните разновидности на едно и също химично съединение се дават различни имена или се означават с буквите от гръцката азбука α, β, γ.
Класическият пример за полиморфизъм е въглеродът. Кристализира в две системи: кубична - диамант и шестоъгълна - графит. Свойствата на тези два минерала са много различни един от друг. Диамантът е забележителен с високата си твърдост, той е най-твърдият от всички познати ни минерали, не провежда електричество. Неговите безцветни и прозрачни кристали имат необичайно силен блясък.
Графитът има съвсем други свойства. Твърдостта му е малка (графитни моливи), лесно се разделя на люспи, провежда добре електричество. Графитните агрегати се отличават със своята непрозрачност и черен или стоманено сив цвят.
Техните плътности също са рязко различни: диамантът има плътност 3,5 - 3,6, графитът има плътност 2,2.
Диамантът се образува при висока температура и много високо налягане, на голяма дълбочина във вътрешността на Земята, графит - на по-малка дълбочина, при по-ниски температури и налягания.
Причината за различните свойства на диаманта и графита се дължи на тяхната структура, т.е. подреждане на въглеродни атоми. В графита връзката на въглеродните атоми е по-малко силна, отколкото в диаманта. Структурата на графита се характеризира с плътно разположение на въглеродните атоми в успоредни равнини (фиг. 25). Във всеки слой атомите са разположени в ъглите на правилни шестоъгълници и между тях има силна връзка. Във вертикална посока слоевете са отдалечени един от друг на големи разстояния и връзката между тях е по-слаба. Полиморфизъм на минералите, които са химически елементи(въглерод, сяра и др.) се нарича алотропия. Добре известни са хексагоналните, ромбичните и моноклинните модификации на сярата.
По-сложни образувания също се срещат под формата на различни полиморфни разновидности: CaCO 3, FeS 2 и др.
Преходът на една полиморфна разновидност (модификация) към друга, причинена например от промяна на температурата, настъпва внезапно, с преструктуриране на структурата при определена характеристика на тази разновидност (ако налягането остава непроменено) и се придружава от отделянето или абсорбирането на топлина.
Добре проучен е полиформизмът на силициевия диоксид (SiO 2 ), който образува три основни разновидности: кварц, тридимит и кристобалит, всяка от които има няколко модификации. С повишаване на температурата кварцът, който е стабилен само до 573 ° C, преминава последователно в редица полиморфни модификации:
Познаването на температурите на полиморфните трансформации на кварца се използва за практически цели (например за получаване на тридимит, огнеупорен материал, който не претърпява трансформации в температурния диапазон 870-1470 ° C, кварцът се нагрява предварително до температура над 870 ° ° С).
Наличието на полиморфни модификации в силициевия диоксид прави възможно използването му като геоложки "термометър". Откривайки една или друга полиморфна модификация сред скалии жилищни отлагания, можем да съдим за температурните интервали, в които е протекло образуването на скалата.
За образуването на полиморфна разновидност на дадено вещество са необходими определени интервали от температура и налягане. При промяна на тези параметри той става нестабилен и теоретично с течение на времето трябва да се превърне в сорт, който е стабилен при нови условия. Но поради много ниската скорост на пренареждане на кристалната решетка при ниски температури, полиморфните разновидности на едно вещество могат да съществуват при едни и същи условия за почти безкрайно дълго време: едното в стабилно състояние, другото в относително нестабилно състояние (за например диамант на повърхността на земята).
Вече споменахме по-горе, че по-голямата част от естествено срещащите се минерали са химически съединения. Сред последните са:
- а) определенивръзки, както единични, така и двойни, и
- б) връзки променлив състав.
Също така широко използван твърди разтвори, или т.нар изоморфни смеси. Твърдите псевдоразтвори трябва да се разграничават от тези истински твърди разтвори, точно както това разграничение се прави в течните разтвори.
И накрая, трябва да се обърне специално внимание водни съединения, представите за които бяха значително усъвършенствани през последните години.
Някои съединения. Всички определени химични съединения, както е известно, стриктно се подчиняват на закона за постоянство на състава, изразен с химични формули, закона за множествените съотношения и закона за дяловете, който свързва съотношенията на компонентите на дадено съединение с техните съотношения в други видове съединения. Тези закони са в пълно съответствие с периодичната система от елементи на Д. И. Менделеев, законите на кристалната химия и учението за симетрията в кристалните среди.
Характерно е, че тези съединения се отличават с редица специални физични свойства, които са ясно видими на физикохимичните диаграми на точка на топене, разтворимост, електропроводимост, твърдост, специфично тегло, показатели на пречупване и др.
Някои химични съединения включват:
- оксиди (Cu 2 O, MgO, Fe 2 O 3, SiO 2 и др.),
- различни кислородни соли (CaCO 3, CaSO 4, AlBO 3, Mg 2 SiO 4 и др.),
- сулфиди (NiS, FeS 2, Sb 2 S 3 и др.),
- халогенни съединения (NaCl, AgBr, CaF 2 и др.) и др.
Химичният състав на химичните съединения може да бъде представен по два начина:
- под формата на емпирични формули и
- под формата на конституционни или структурни формули.
Емпиричните формули изразяват състава на минералите или под формата на елементи, включени в съединението (например BaSO 4, Na 3 AlF 6, NaAlSi 3 O 8 и др.), Или под формата на редица най-прости съставни съединения BaO SO 3, 3NaF AlF 3, Na 2 O Al 2 O 3 6SiO 2 и др.). Последният тип формули, въпреки че не отговаря на съвременните представи за природата на химичните съединения, обаче има предимството, че улеснява запомнянето на състава на минералите.
Значителни корекции в очертанията на формулите на по-сложни съединения се правят от данни от кристалохимия, базирани на рентгеново дифракционно изследване на минерали. Тъй като повечето неорганични кристални вещества се характеризират с йонни връзки на структурни единици, е важно тези структурни елементи (йони и комплекси), установени в различни видове кристални структури, да бъдат отразени във формулите на химичните съединения. Анионните комплекси в този случай обикновено се отделят от катионите с квадратни скоби, например Mg 2, Ca 3 2, Mg 2, Na и др.
Двойни връзки. В допълнение към простите химични съединения, двойните съединения са често срещани в природата, особено двойните соли. Двойните соли са такива специфични съединения, които се състоят, така да се каже, от две прости соли, присъстващи в множество съотношения. В повечето случаи тези соли са двойни в катиони, по-рядко в аниони или едновременно в катиони и аниони. Като примери могат да се дадат: CaMg 2 , K 3 Na 2 и др.
При сравняване на формулите на двойни соли се оказва, че катионите, включени в техния състав, поради значителната разлика в техните йонни радиуси, не могат изоморфно да се заменят един друг: Ca 2+ (1,01, Å) и Mg 2+ (0,75 Å ), K 1 + (1.33Å) и Na 1+ (0.98Å) и т.н. Следователно не е изненадващо, че те се различават от съставните си прости соли по някои характеристики на кристалните структури и често физични свойства.
Съединения с променлив състав. В допълнение към някои химични съединения има доста такива съединения, чийто състав не е постоянен, а се колебае в тесни или по-широки граници и тези колебания в състава не могат да се обяснят с механични примеси на чужди вещества. Напротив, променливият състав на съединенията от кристалохимична гледна точка намира обяснение в ограничената разтворимост на съставните компоненти в дадено съединение. Такива химически образувания се наричат съединения с променлив състав.
Сред минералите съединенията с променлив състав са многобройни. Сред тях, на първо място, трябва да отбележим онези двойни соли, в които техните прости соли, въпреки че имат сходно изградени кристални решетки, не проявяват пълен изоморфизъм поради значителна разлика в размерите на йонните радиуси или поради разлики в поляризационните свойства . Поради това те се характеризират с частична флуктуация на състава, изразяваща се в неточно съответствие на неговите химични формули със строго стехиометрични съотношения на компонентите.
В малки количества изоморфни примеси на други компоненти се намират в много прости и сложни съединения. Те включват например сфалерит (ZnS), в който съдържанието на желязо под формата на изоморфен примес достига няколко процента. В описанието на минералите ще бъдат дадени много други примери.
Химичните съединения с променлив състав не се различават по свойствата си от твърдите разтвори и трябва да се разглеждат като такива, но с ограничена смесимост на компонентите.
Твърди разтвори. Способността на кристални вещества с различен състав да образуват смеси от една и съща кристална структура, непрекъснато променящи се в състава си, до голяма степен се основава на изоморфизма, т.е. свойството на елементите да се заместват взаимно в химични съединения със сходен състав.
Изоморфизъм на две вещества има, когато те имат подобна химична формула и когато зарядите на съответните йони на двете вещества са еднакви по знак, а размерите на йоните и степента им на поляризация не излизат извън известните граници, т.е. те са равни с определена степен на точност.
AT природни условия, например, широко разпространен изовалентенизоморфизъм на Mg 2+ (йонният радиус е 0,75 Å) с двувалентни йони Fe 2+ (0,79 Å), Ni 2+ (0,74 Å), Co 2+ (0,77 Å), Zn 2+ (0,79 Å) и Mn 2 + (0.91Å). Друг пример е изоморфизмът на тривалентни йони: Fe 3+ (0,67Å), Cr 3+ (0,64Å), Al 3+ (0,57Å), Mn 3+ (0,70Å), V 3+ (0,65Å), Ti 3 + (0,69Å). Същото важи и за сложни структурни единици, участващи в структурата на кристалните решетки, например 2-, 2- и т.н.
Но заедно с това е установено и потвърдено експериментално, че по време на образуването на минерали с променлив състав в кристални структури не само прости йони (или атоми) могат да бъдат заменени с други, изовалентни йони (или атоми), но и цели групи от йони могат да бъдат заменени с групи от други йони с различна валентност, но със същата сума от всички валенции. Този случай се нарича хетеровалентенизоморфизъм. Такъв е например изоморфизмът в серията плагиоклази, където групата NaAlSi 3 O 8 в много различни съотношения може да бъде заменена от групата CaAl 2 Si 2 O 8 с образуването на кристали от същия клас на симетрия. По същество тук имаме замяната на Na 1+ Si 4+ с Ca 2+ Al 3+ .
При хетеровалентен изоморфизъм размерите на заместващите се взаимно структурни единици (атоми, йони, йонни комплекси) все още играят решаваща роля: те трябва да бъдат повече или по-малко еднакви. Разликата в радиусите на заместващите се компоненти, както показват сравненията, обикновено не надвишава 15% от по-малкия радиус.
Както знаем, йонните радиуси във вертикалните групи на периодичната система от елементи нарастват с увеличаване на поредния номер и намаляват в хоризонтална посока с увеличаване на номера на групата (т.е. с увеличаване на валентността). На тази основа А. Е. Ферсман извежда закона за диагоналните редици от изоморфни йони в периодичната система от елементи, който е валиден за нейната лява страна. Очертани са следните хетеровалентни йонни изоморфни серии (йонните радиуси в ангстрьоми са показани в скоби):
- Li 1+ (0,69) -Mg 2+ (0,75) -Sc 3+ (0,81) -Zr 4+ (0,82)
- Na 1+ (0,98) -Ca 2+ (1,01) -Y 3+ (1,06)
- K 1+ (1.33) -Sp 2+ (1.27)
- Rb 1+ (1,48)-Ba 2+ (1,36)
- Al 3+ (0,57) -Ti 4+ (0,65) -Nb 5+ (0,70)
Наистина, в природните съединения често наблюдаваме, че литиевите минерали, например, съдържат изоморфни магнезиеви примеси, магнезиевите минерали - скандиеви примеси, натриевите минерали - калциеви примеси, калциевите минерали - итриеви примеси и т.н.
В допълнение, в сложните аниони 4- йонът може да бъде заменен с 5-, 3- и 2- йони, които имат същите или подобни размери. На примери за казаното ще спрем повече от веднъж, когато описваме минералите.
От генетична гледна точка е важно да се прави разлика между два вида твърди разтвори:
- истински твърди разтвори и
- твърди псевдо разтвори.
Истински твърди разтвори, или, както се наричат по друг начин, изоморфни смеси *, са смеси с напълно хомогенна кристална структура във всякакви пропорции на две или повече вещества, които не образуват химични съединения. Примери за това са твърди разтвори на злато и сребро, манганови и железни волфрамати, плагиоклази и др.
* (В литературата има и синоним на "смесени кристали" (буквален превод от немски език). Заглавието не е съвсем правилно.)
Физическите и химичните свойства на твърдите разтвори са адитивни*, т.е. постепенно и закономерно се променят с увеличаване на съдържанието на втория компонент. Това са например промяната в точката на топене, специфичното тегло, показателите на пречупване, отразяващата способност, електропроводимостта и др. Промените във всички тези свойства в диаграмите се изразяват под формата на прави линии (за специфично тегло) или плавно извити криви (точки на топене, оптични свойства и др.). Тези криви за изоморфни серии са толкова характерни, че според съвкупността от изследваните свойства на всеки даден минерален типте могат да се използват за определяне на неговия състав, без да се прибягва до химичен анализ. Например, не е трудно да се определи съставът на плагиоклаза по този начин, като се използват специални диаграми, като се изследват неговите оптични свойства в тънки срезове под микроскоп.
* ("Addo" - добавяне)
Има два вида истински твърди разтвори:
- а) заместващи твърди разтвори (или разтвори от първи вид) и
- б) интерстициални твърди разтвори (или разтвори от втори вид).
а) Заместителните твърди разтвори са особено характерни за металите и йонните съединения. Тяхната същност се свежда до факта, че в съединения с подобно изградени кристални решетки атомите или йоните на едно съединение се заменят с други (т.е. заемат мястото на други). Това са например изоморфни серии: ZnCO 3 -FeCO 3, MnWO 4 -FeWO 4 и др.
б) Интерстициалните твърди разтвори се характеризират с факта, че вторият компонент се намира само в кухини, т.е. в празнините между атомите или йоните, които изграждат кристалната решетка на първия компонент. Този вид твърд разтвор може да се получи само при условие, че размерите на атомите (йоните) на двата компонента са рязко различни един от друг. Най-характерният пример за този вид твърд разтвор е разтвор на въглерод в желязо, който лесно се образува при високи температури и се разлага на желязо и железен карбид (Fe 3 C) при бавно охлаждане.
В химичните формули на твърдите разтвори изоморфните атоми или йони са поставени в скоби, разделени един от друг със запетаи и подредени в низходящ ред на съдържание: (Au,Ag), (Zn,Fe)S, (Zn,Fe)CO 3, (Fe ,Mn)WO 4 и др. Малките изоморфни примеси или изобщо не са посочени във формулата, или са въведени с по-малък шрифт. Ако един от компонентите в двойна сол съдържа изоморфни примеси, тогава формулата се показва, както следва: Ca(Mg,Fe) 2 .
Твърди псевдо решенияте се различават от истинските по това, че съдържат фино диспергирани примеси от чужди вещества, чието присъствие не може да се обясни въз основа на законите на кристалохимията. Примери за твърди псевдоразтвори са кристалните золове (стр. 39), по-специално такива цветни полупрозрачни минерали като розов кварц, червен калцит, черен сфалерит и др., които изглеждат напълно хомогенни (оцветяващият пигмент е толкова фино разпределен в тях).
Водни връзки. Първо трябва да направим следната важна забележка. Водните съединения трябва да включват само тези, които съдържат електрически неутрални съединения в състава си. водни молекули. Преди това под прикритието на водни съединения се разглеждат и минерали, съдържащи хидроксилни аниони [OH] 1-. Въпреки това, между молекулата на H 2 O и отрицателно заредения [OH] 1- йон, разбира се, има фундаментална разлика, която има много значителен ефект върху физическите и химични свойстваминерали. Хидроксилът, като йон, е в състояние да замени аниони като F 1-, Cl 1- в съединения и се държи здраво в кристални решетки. Молекулата H 2 O няма това свойство и, тъй като е слабо свързана в решетката, лесно се отстранява при нагряване. Фактът, че хидроксилът при калциниране на съдържащите го минерали, напускайки кристалната решетка, може да се превърне във водна пара, в никакъв случай не може да служи като основа за идентифицирането му с молекулата на H 2 O. Следователно е много важно да посочете отделно наличието на хидроксил и вода в химичните формули на минералите. От тази гледна точка, например, малахитът - Cu 2 2 не е вода, а основният безводен меден карбонат, въпреки че при химически анализ хидроксилът се определя под формата на H 2 O. Същото важи и за минералите, които са киселинни соли , в който сред катионите има водород.
В зависимост от това как се задържа водата в минералите, има:
- кристализация или свързана водавключени в кристалните решетки на минералите и
- свободна вода, която не участва в структурата на самото кристално вещество
свързана водаучаства в решетката под формата на молекули Н 2 О, заемайки строго определени места в нея. Броят на водните молекули е в прости съотношения към другите компоненти на съединението. Следват примери: Na 2 CO 3 10H 2 O (сода), CaSO 4 2H 2 O (гипс), Ni 3 2 8H 2 O (анабергит), Al 2 3 5H 2 O (уейвелит) и т.н. - наречени кристални хидрати, които според Вернер трябва да се разглеждат като "комплексни съединения", т.е. тези, в които водните молекули като структурни единици са подредени в определена координация около някои йони, като по този начин създават един вид сложни йони.
И така, в кристалната структура на съединението NiSO 4 6H 2 O, рентгенови изследвания са установили, че шест диполни H 2 O молекули директно обграждат катиона Ni 2+, очевидно ориентирайки се по определен начин по отношение на катиона (две H 1+ протони към периферията на комплексния йон) . Тъй като самата H 2 O молекула е електрически неутрална, хидратираният 2+ катион запазва заряда на Ni 2+. Ето защо химична формулавръзките трябва да бъдат написани така:
На въпроса за причината за хидратацията на йони в кристалните решетки ще се спрем по-късно (във въведението към кислородните соли). Тук можем само да посочим, че необходимостта от хидратация на йоните е строго кристалохимично обоснована; за образуването на стабилни кристални решетки от такива аниони с голям размер като 2-, катионите Ni 2+, присъстващи в разтвора, са твърде малки, поради което има желание да се увеличи обемът им, без да се променя зарядът. От само себе си се разбира, че образуването на кристални хидрати може да се случи само в среда, богата на вода, и при ниски температури.
При нагряване кристалните хидрати лесно се дехидратират, ако не напълно наведнъж, то рязко, като периодично губят част от водните молекули. В този случай пренареждането на решетката се извършва при запазване на рационалните съотношения между броя на молекулите на H 2 O и основното съединение. Например халкантитът (CuSO 4 5H 2 O) по време на изкуствена дехидратация образува първо CuSO 4 3H 2 O, след това CuSO 4 H 2 O и накрая CuSO 4 . В същото време физични свойства като показатели на пречупване, специфично тегло и др., също се променят рязко. различни съединенияводата се отстранява при различни температури: някои от тях я губят при стайна температура (многоводни медни и железни сулфати), други при по-високи температури и дори при температури над 100 °.
безплатна вода, присъстващ в минералните маси, се характеризира с това, че не участва пряко в структурата на кристалната решетка на минералите. При нагряване се освобождава постепенно. Има три вида безплатна вода:
- а) зеолит
- б) колоидни и
- в) хигроскопичен
Зеолитната вода е получила името си от общото наименование на специална група минерали - зеолити, в които особеностите на нейното присъствие се проявяват най-ясно. Установено е, че водните молекули в тази група минерали не заемат някакво строго определено положение в кристалната решетка, а се разполагат само в свободни кухини в нея (по канали, в междуслойни пространства и др.). Следователно "разтворимостта" на водата в тях е значително ограничена. Интересното е, че количеството вода в тях може да се промени, без да се нарушава кристалната хомогенност на веществото с постепенна промяна на физичните свойства: степента на прозрачност, индексите на пречупване, специфичното тегло и т.н. Това показва, че водата е в състояние на твърд разтвор . При нагряване се отделя в диапазона 80-400°. Любопитно е, че зеолитите, дехидратирани чрез внимателно нагряване, отново могат да абсорбират вода с възстановяване на предишните си физически свойства.
Колоидната вода, както показва самото име, е широко разпространена в хидрогеловете, където се задържа на повърхността на дисперсните фази (стр. 37) от много слаби свързващи сили. По същество това е адсорбционна вода и нейното присъствие не зависи от решетката на адсорбента (самият адсорбент, разбира се, може да съдържа кристално химически свързана вода). Пример е опал (силициев хидрогел) - SiO 2 aq (aq са първите две букви от латинската дума "aqua" - вода). Това обозначение на колоидна вода, възприето от някои автори, трябва да се признае за рационално.
Хигроскопичната (капилярна) вода се задържа в тънки пукнатини, пори и прахообразни маси от сили на повърхностно напрежение. В по-голямата си част се отстранява лесно при нагряване до 100-110 °. Не може да се направи рязка граница между капилярна и колоидна вода.
За определяне на химичния състав на минерала се извършва неговия химичен анализ и се определя химичната формула на минерала. Формулите могат да бъдат емпирични, показващи само химичния състав и структурни, даващи представа за пространственото разположение на атомите в минерала и връзката им един с друг. За някои минерали все още не са установени структурни формули. Но благодарение на рентгеновите методи за изследване в много случаи беше възможно да се определи връзката на атомите в кристалните структури на минералите. С тези въпроси за връзката на химията със структурата на материята и нейните свойства се занимава кристалохимията.
В минералите е важно да се идентифицират катиони и анионни комплекси, които характеризират типовете кристални структури. При писане на минерални формули анионните комплекси се отделят от катионите с квадратни скоби, например сидерит Fe. Трябва да се има предвид, че емпиричните формули на минералите не отразяват характеристиките на тяхната вътрешна структура и в минералогията те в момента се заменят с структурни формули. И така, емпиричната формула на минерала мусковит е H 2 KAl 3 Si 3 O 12, а структурната формула е KAl 2 (OH,F) 2. Последното показва, че има сложен анионен комплекс в структурата на мусковита и че водата в мусковита не е под формата на H 2 O, а под формата на хидроксил (OH) - , и този хидроксил на свой ред може да бъде заменен с F - .
В минералогията често се разграничават безводни и водни минерали (сулфати, фосфати, карбонати и др.). Водните минерали включват онези минерали, които съдържат електрически неутрални водни молекули. Водата в състава на минералите може да бъде свързана и свободна. Свързаната или кристализираща вода навлиза в кристалната решетка на минералите, заемайки определени места в нея. Примери са някои карбонати и сулфати, като гипс. Свободната вода не участва в структурата на кристалната решетка на минералите, нейното количество може да бъде различно в зависимост, например, от температурата. Примери за свободна вода са зеолитната вода. И, разбира се, цялата хигроскопична вода, задържана в микроскопични пукнатини в минерали и скали от силите на повърхностното напрежение, също е свободна. Отстранява се чрез нагряване до 110°C. Хидроксилсъдържащите минерали в строгия смисъл на думата не могат да бъдат наречени водни минерали. Има фундаментална разлика между електрически неутралната водна молекула H 2 O и отрицателно заредения хидроксилен йон (HO). Хидроксил (HO) - може да замести йони като Cl - и Fe - в минералите, той е здраво задържан в кристални решетки и водните молекули не притежават тези свойства.
Задача 3.Изследване на формите на естествено отделяне на минерали.
Морфология на минералите и агрегатите. близнаци
Сраствания на кристали
За някои минерали (фелдшпати, рутил, каситерит, арагонит, цинобър и много други) е характерно образуването не само на единични кристали, но и на техните двойни сраствания - близнаци. При реални, а не случайни снаждания, индивидите растат заедно по едни и същи плоски решетки на техните пространствени решетки. Геометрично, индивидите в двойник могат да бъдат мислено комбинирани един с друг или чрез отражение в равнината на симетрия, или чрез въртене около оста Л 2. Двойките могат да се състоят от чифт кристали (прости) или от множество повтарящи се индивиди. характерна особеностдвойниците на фасетите са входящите ъгли между лицата; такива ъгли не съществуват на единични идеално развити кристали. Необходимо е да се прави разлика между слети близнаци и кълняеми близнаци. В първия индивидите са разграничени по равнината, изглежда, че са в контакт един с друг. Второ, кристалите, така да се каже, надрастват един друг или проникват един в друг през и през, докосвайки се по сложна криволичеща (стъпаловидна) повърхност. Близнаците се образуват по различни причини. В разтвор, когато кристалите все още са в състояние на нуклеация и под действието на определени сили се обръщат един спрямо друг. По време на прехода от една полиморфна модификация към друга. При механични въздействия върху нарастващи кристали.
фалшиви кристали–псевдоморфи
Псевдоморфозата е кристал или зърно от минерал, който е заменен без промяна на формата си с друг минерал или смес от минерали, откъдето идва и името фалшива (псевдо) форма (морф). Тези образувания често запазват и най-малките детайли от повърхността на оригиналните кристали и зърна (фиг. 27).
Ориз. 27. Кварц от азбестови вени:
т.нар "Тигрово око" - жълто и "Ястребово око" - синьо
Псевдоморфозите могат да се използват за преценка химична реакцияминерално образуване, тъй като както оригиналният минерал (зърно), така и крайният продукт на трансформацията са видими едновременно. При повърхностни условия кристалите на пирит се заменят с лимонит - гъста кафява прахообразна маса, смес от различни Fe 3+ хидроксиди (фиг. 28).

Ориз. 28. Лимонит псевдоморфа след пиритна конкреция, 4 см,
"Бялата пустиня", Египет
Друг начин за образуване на псевдоморфози са полиморфните трансформации на вещества с промени в температурата и налягането, те се наричат параморфози. Например, параморфози на алфа кварц с бета кварц ( Tтрансформация 575 0 С при 100 kPa). Има и кухи псевдоморфни отпечатъци в скалната маса от кристали от разтворени минерали, чието място е останало незаето (фиг. 29).

Ориз. 29. Кварц от флуорит
Частична псевдоморфна подмяна на повърхността с последващо замърсяване на заменените участъци с кварцови кристали. Самият флуорит впоследствие се разтваря, оставяйки централни кухини под формата на отрицателен куб. Проба 9 см, Кадамджай, Киргизстан.
Минерални агрегати
В природата отделните добре фасетирани кристали са сравнително редки, по-често минералите образуват различни клъстери - агрегати. В минералогията те обикновено се подразделят според морфологията: пръстени, зърнести, плътни, агрегати; друзи, четки, секрети, конкреции, оолити, сферулити, агломерирани агрегати, дендрити, набези и петна.
Земните агрегати са брашнести агрегати от много фини минерални зърна. Този тип агрегати са най-широко представени в земната кора. Зърнестите агрегати са рохкави или непрекъснати маси от произволно враснали зърна от един (мономинерални) или няколко (полиминерални) минерала. Всяко зърно е необрязан, неоформен кристал, който е израснал в тесни условия. В зависимост от размера на зърната се делят на едрозърнести (>5 mm), среднозърнести (1–5 mm), дребнозърнести (<1 мм). Характерный пример – полнокристаллические магматические породы (граниты и пр.).
Ориз. 30. Среднозърнест амазонит гранит агрегат
Сред минералите той разграничава три групи, които имат характерен вид на кристали:
- изометричен, еднакво развит и в трите направления - магнетит, пирит, гранат;
- удължени в една посока, призматични, стълбовидни, игловидни и лъчисти, - барит, кварц;
- удължени в две посоки, пластинчати, ламелни, листовидни и люспести, - хлоритни и др.
В съответствие с външния вид на кристалите се образуват различни видове минерални агрегати: листни (а), люспести (б), влакнести (в) и (г), радиално лъчисти (д), колоновидни (е) (фиг. 31). ).
а  b
b 
в  Ж
Ж 
д  д
д 
Ориз. 31. Листен агрегат - талк ( а), среден люспест агрегат - парагонит ( b), дълговлакнест агрегат - хризотил азбест ( в), радиално-лъчист агрегат - егирин (d), стълбовиден агрегат - кианит (e), влакнест агрегат - гипсов селенит (e)
Паралелно колонен (фиг. 31, д) и влакнести агрегати (фиг. 31 в, Ж) обикновено се образуват в пукнатини. Това са вени от копринен гипс, серпентинов азбест, колонен калцит. В някои случаи тези агрегати кристализират в отворени пукнатини: първо, друзите растат по стените според принципа на геометричната селекция; нараствайки един към друг, те се затварят и образуват успоредни стълбовидни или влакнести агрегати. В други такива агрегати се образуват в постепенно отварящи се пукнатини, когато скоростта на отваряне е по-малка или равна на скоростта на растеж на индивидите. Първо, пукнатината се запълва със зърнест минерален агрегат под формата на непрекъсната тънка жилка. След това, когато зърната се отварят, опират се едно в друго, те могат да растат само след разширяващите се стени на пукнатината. Те постепенно се разтягат нормално към стените, образувайки успореден стълбовиден или влакнест агрегат.
Спечени агрегати
Синтерните форми на минерални образувания възникват поради колоидни разтвори - гелове. Бавно мигриращите колоидни разтвори, попадайки в празнини, обгръщат стените им, постепенно губят вода и се сгъстяват. В резултат на това се образуват различни форми на агрегати:
- сталактити - висящи под въздействието на гравитацията от горните части на кухините;
- сталагмити - образувани в долните части на кухините поради падащи капки;
- бъбрековидни агрегати - най-често срещаните сред синтровите форми, срещат се в повърхностни условия.
Размерите на такива образувания са различни: от микроскопични до големи стълбовидни инкрустации в пещерите. В синтрови форми се срещат различни минерали: железни и манганови хидроксиди, опал, малахит, гипс, арагонит, калцит и др. Синтровите образувания в напречния разрез имат зонално-концентричен строеж.
Друзите (четките) са групи от кристали, които са израснали перпендикулярно или почти перпендикулярно на повърхността на пукнатини, стените на вена или кухина в скала. Първо, единичните кристали растат, растат, влизат в контакт един с друг, опират се един в друг и си пречат да растат. Продължават да растат само тези кристали, чийто вектор на растеж е ориентиран към свободното пространство, т.е. нормално спрямо повърхността на пукнатината. Проби от друзи са показани на фиг. 32 аи b.
а  b
b 
Ориз. 32. Друза от кварц ( а), четка от аметистови кристали ( b)
Секретите се образуват, когато всяка кухина в скалата се запълни с минерална материя. Често в центъра на секретите има друзи. Най-често секрети от халцедон с кварцови друзи вътре, ограничени до сливиците в базалт. Секретите с вътрешни кухини се наричат геоди (фиг. 33).

Ориз. 33. Тъмнокафяв халцедонов ахат с кварцова друза в центъра
Конкрецията е сферичен (понякога като сплескан, неправилно заоблен) минерален агрегат с радиално лъчиста структура (фиг. 34). За разлика от секретите (жеодите), те растат около център. В центъра на конкремента често има зърно, което е служило за семе при растежа му. Най-често конкрециите се образуват в порести седиментни скали – пясъци и глини. Размерите на тези образувания варират от милиметри до десетки сантиметри, а понякога дори до метър и повече. Те са разнообразни по форма и структура. Конкрементите могат да бъдат плътни кристални (излъчени или гранулирани); криптокристален (кремък); насипни и земни (лимонит, вивианит).
Седиментните скали често съдържат конкреции от пирит, марказит, силициев диоксид (кварц, халцедон, кремък), карбонати и фосфорити. Феромангановите конкреции представляват научен и практически интерес, те се образуват в огромни количества на океанското дъно и се считат за обещаващ суровинен ресурс на бъдещето.
Екзотично разнообразие от нодули с карбонатно-глинен състав, срещащи се само в седиментни скали и характеризиращи се с наличието на множество изсъхващи пукнатини вътре, се нарича септария (фиг. 35).
. 

Ориз. 34. Нодула Фиг. 35. Септария
Оолитите са сферични или елипсовидни образувания от калциев карбонат, оксиди на желязо и манган, силициев диоксид и др., имащи концентрично-черупчеста, понякога радиално лъчиста структура (около централното ядро). Ядрото може да бъде фрагменти от черупки, пясъчни зърна, камъчета и др. Минерали като калцит, арагонит и пиролузит често се срещат под формата на оолити.
Оолитите се образуват по време на утаяване (в суспензия, във вода), по време на диагенеза и по време на други етапи на трансформация на утайката по време на циркулацията на разтвори в кухини. Най-често оолитите се образуват в горещи извори, в придънни езерни и морски тини.
Често се срещат във варовици, железни руди, боксити (фиг. 36), силикатни скали и др. Оолитите са с размери от милиметри до няколко сантиметра. Оолитите, по-големи от 2–5 mm, се наричат пизолити.

Ориз. 36. Оолитови боксити
Сферолитите и бъбрековидните агрегати са наречени според тяхната морфология. Сферолитите много често имат почти правилна сферична форма и размери от фракции до 1–2 cm или повече. Те растат като топки върху други минерали и по стените на различни кухини в руди и скали. Сферолитите се образуват или в резултат на разцепения растеж на кристалите, или в тях, както в конкрециите, има ядро-зърно, върху което расте минералът. Поради геометрична селекция или ограничени условия, кристалите могат да растат само чрез излъчване от центъра на сферолита (фиг. 37).
Ориз. 37. Сферулит
Бъбречните агрегати се състоят от много съседни "пъпки", всяка от които, подобно на сферулит, има радиално лъчиста структура (фиг. 38). Бъбречните агрегати от гьотит HFeO 2 H 2 O и малахит Cu 2 (CO 3) (OH) 2 имат особено типична структура. Образуването им се извършва на неравна повърхност поради груповия растеж и геометричната селекция на сферолитите; само онези сферолити, които са били върху издатините на субстрата, са останали и са се разраснали. Най-често бъбрековидни агрегати се образуват в различни кухини в приповърхностни зони на разрушаване и изветряне на руди и скали.

Ориз. 38. Бъбрековиден агрегат от радиално-лъчист хематит
Дендритите са фигури под формата на дървесни клони, образувани поради бързото нарастване на кристалите в някои посоки. Те се срещат на повърхността на скалите по тънки пукнатини. Дендритите са особено характерни за мангановите оксиди (фиг. 39).

Ориз. 39. Дендрити от манганови оксиди (вернадит) върху сиенит
Земните маси са меки брашнени скрити гранулирани образувания. Често се наблюдават под формата на кори и натрупвания, които възникват най-често при химическо изветряне на скали и руди. В зависимост от цвета земните маси се наричат сажди (черни маси от манганови хидроксиди), охрени (жълто-кафяви маси от железни хидроксиди).
