Die Formel des Minerals, das. Chemische Zusammensetzung von Mineralien, Berechnung von Formeln
Jedes Mineral hat eine spezifische chemische Zusammensetzung. kann aus einem oder mehreren chemischen Elementen bestehen. Wenn ein Mineral aus einem chemischen Element besteht, wird es als natives Element bezeichnet. Zum Beispiel natives, natives Silber, natives usw. Die meisten Mineralien bestehen jedoch aus mehreren und manchmal vielen chemischen Elementen. Die Zusammensetzung von Mineralien wird normalerweise in Form einer chemischen Formel oder in Gewichtsprozent ausgedrückt, die durch chemische Analysen bestimmt wird.
Beispielsweise kann die chemische Zusammensetzung von Chalkopyrit- und Analcim-Mineralien als die folgenden Gewichtsprozentsätze an chemischen Elementen (für das erste) oder Oxide (für das zweite) ausgedrückt werden:
I. (Cu – 34,9) + (Fe – 30,47) + (S – 34,6) = Summe 99,97
II. (SiO 2 – 55,12) + (Al 2 O 3 – 22,99) + (Na 2 O – 13,53) + (H 2 O – 8,27) = Gesamt 99,81
Die Formeln für diese Mineralien werden berechnet, indem die angegebenen Gewichtsmengen durch die entsprechenden Atom- oder Molekulargewichte dividiert werden. Dabei werden atomare oder molekulare Mengen erhalten. Die Atommassen chemischer Elemente werden aus der Tabelle des Periodensystems der Elemente von D. I. Mendeleev entnommen, das Molekulargewicht des Oxids wird durch Summieren der Atommassen abgeleitet, aus denen das entsprechende Elementoxid besteht. Atomare oder molekulare Größen werden in der resultierenden Formel durch ihre proportionalen Koeffizienten ersetzt. Beispiele zur Berechnung der Formel von Chalkopyrit und Analcim sind in der Tabelle angegeben. 7.
Die Formeln, die während der Berechnung erhalten werden und eine Vorstellung von der chemischen Zusammensetzung des Minerals geben, werden als empirisch bezeichnet. Dies sind die erhaltenen Formeln von Chalkopyrit und Analcim - 4Si02 Al203 NagO 2H20. Die in Form von Oxiden geschriebene empirische Formel von Analcim spiegelt nicht die Beziehungen zwischen chemischen Elementen wider und sagt nichts über die Struktur des Minerals aus. Eine solche Schreibweise der Formel hat einen Vorteil - sie ist leichter zu merken.
| Neuberechnung der chemischen Analysedaten und Erstellung der Mineralformel Tabelle 7 | ||||
| Komponenten | Gewichtsprozent | Atomare (molekulare) Größen | Beziehungen zwischen Atomen (molekularen) Größen | Name und Formel des Minerals |
| Cu | 34,9 | 34,9: 63,5 = 0,550 | 1 | CuFeS2 |
| Fe | 30,47 | 30,47: 55,8 = 0,546 | 1 | |
| S | 34,6 | 34,6: 32 = 1,081 | 2 | |
| SiO2 | 55,12 | 55,12: 60 = 0,919 | 4 | 4SiO2 Al2O3 Na2O 2H2O |
| Al2O3 | 22,99 | 22,99: 102 = 0,225 | 1 | |
| Na2O | 13,53 | 13,53: 62 = 0,218 | 1 | |
| H2O | 8,27 | 8,27: 18 = 0,459 | 2 | |
Für eine Reihe von Mineralien ist es üblich, Formeln zu schreiben, die die Art der chemischen Verbindung und die gegenseitigen Bindungen zwischen den chemischen Bestandteilen widerspiegeln. Solche Formeln nennt man Struktur- oder Kristallchemikalien. Die Formel von Analcim ist Na H 2 O; ist strukturell. Die eckigen Klammern markieren das Radikal, das einen komplexen anionischen Komplex darstellt, der im Mineral in der Menge eines Moleküls vorhanden ist, wird am Ende der Formel geschrieben und durch einen Punkt davon getrennt. Ein anderes Beispiel. Die empirische Formel von Muskovit ist H 2 KAl 3 Si 3 O 12 , die Strukturformel ist KAl 2 (OH, F) 2 . In dieser Formel wird ein komplexer anionischer Komplex als Radikal isoliert und liegt im Mineral nicht in Form von H 2 O, sondern in Form von Hydroxyl (OH) – vor, das durch ein anderes Komma ersetzt werden kann. Das chemische Element an erster Stelle in Klammern ist in größerer Menge vorhanden. Beispielsweise lautet die Ankerit-Formel Ca (Mg, Fe) 2 2 . Durch die Röntgenbeugungsanalyse ist es inzwischen möglich, die Strukturformeln vieler Minerale aufzuklären.
DAS KONZEPT DER MINERALIEN UND MINERALOGIE
Mineralien sind Naturstoffe (chemische Verbindungen, seltener Elemente) mit bestimmten chemischen und physikalischen Eigenschaften. Das Wort "Mineral" bedeutet Erzstück, ein Stück Erz.
Gestein, wie Granit, ist auch ein Produkt geologischer Prozesse in Erdkruste, kann nicht als Mineral bezeichnet werden, da es physikalisch und chemisch heterogen ist verschiedene Teile. Granit umfasst sowohl Quarz mit seiner Zusammensetzung und Struktur als auch Feldspat und Glimmer, die sich von Quarz und voneinander unterscheiden.
Mineralogie ist die Wissenschaft, die Mineralien untersucht. Die moderne Mineralogie untersucht den Ursprung (Genese) von Mineralien, die Muster ihrer Verteilung in der Natur (Paragenese) sowie die Bedingungen für ihre Umwandlung in andere Mineralien, da jedes der Mineralien in einem bestimmten Temperaturbereich gebildet und stabil ist. Druck und Konzentration chemischer Elemente. Zur Aufgabe der Mineralogie gehört auch das Studium der Morphologie (Aussehen), physikalische Eigenschaften, chemische Zusammensetzung und innere Struktur von Mineralien.
Mineralien sind wichtig in der Volkswirtschaft: Sie werden als Baustoffe, Edel- und Rohstoffe verwendet Halbedelsteine, Erze aus Eisen-, Nichteisen- und seltenen Metallen, landwirtschaftliche Erze usw.
Die Suche nach ihnen ist nur auf der Grundlage der Kenntnis der Bildungsgesetze von Mineralien in einer bestimmten natürlichen Umgebung rational.
Die Mineralogie ist eng mit dem gesamten Zyklus der geologischen Wissenschaften verbunden: Geologie, Petrographie und Geochemie, das Studium der Mineralien. Die Mineralogie ist auch mit dem Zyklus der physikalischen und chemischen Wissenschaften verbunden: Chemie, Physik, Kristallographie.
Die Erdkruste besteht aus Mineralien. Etwa 2000 von ihnen sind bekannt. Großer Teil Mineralien in der Natur befinden sich in einem festen Zustand; flüssige Mineralien (Quecksilber, Wasser, Öl usw.) und gasförmige ( Kohlendioxid, brennbare Gase, Schwefelwasserstoff, Schwefeldioxid usw.).
Die Menschen haben lange gelernt, synthetische Produkte herzustellen, die in Eigenschaften, Zusammensetzung und Struktur Mineralien ähneln. Sie werden als künstliche Mineralien bezeichnet (z. B. Quarz, Korund, Glimmer usw.).
Die Namen von Mineralien werden nach charakteristischen physikalischen Eigenschaften (z. B. Magnetit), nach chemischer Zusammensetzung (Schwefelkies) oder nach dem Ort der ersten Entdeckung (Labrador, nach dem Namen der Labrador-Halbinsel in Nordamerika), zu Ehren von Wissenschaftlern oder Persönlichkeiten des öffentlichen Lebens (Biotit - schwarzer Glimmer, zu Ehren des Physikers Biot). Die meisten Mineralien haben mehrere Namen.
^
CHEMISCHE ZUSAMMENSETZUNG UND FORMEL DER MINERALSTOFFE
Die Zusammensetzung des Minerals wird durch chemische Analysen im Labor bestimmt. Zuerst wird der Gehalt an Oxiden oder einzelnen Elementen in Prozent bestimmt, dann werden die erhaltenen Daten durch die chemische Formel des Minerals ausgedrückt.
Zum Beispiel, chemische Analyse Kupferpyrit (Kupferkies) ergibt folgende Zusammensetzung: Fe = 30,27 %; Cu = 34,98 %; S = 35,75 %.
Um die chemische Formel zu bestimmen, müssen die bei der Analyse erhaltenen Zahlen durch die entsprechenden Atom- oder Molekulargewichte dividiert werden. Als nächstes werden die atomaren oder molekularen Mengen von Elementen oder Oxiden miteinander verglichen und ihre Vielfachverhältnisse ermittelt. Sie dienen als Koeffizienten in der chemischen Formel des Minerals (Tabelle 3).
Tisch 3
Ein Beispiel zur Bestimmung der Formel von Chalkopyrit
| Chemische Elemente | Menge der Substanz, % | Atomare Mengen | Das Verhältnis zwischen Atommengen | Formel |
| Fe | 30,27 | 1 | CuFeS 2 |
|
| Cu | 34,98 | 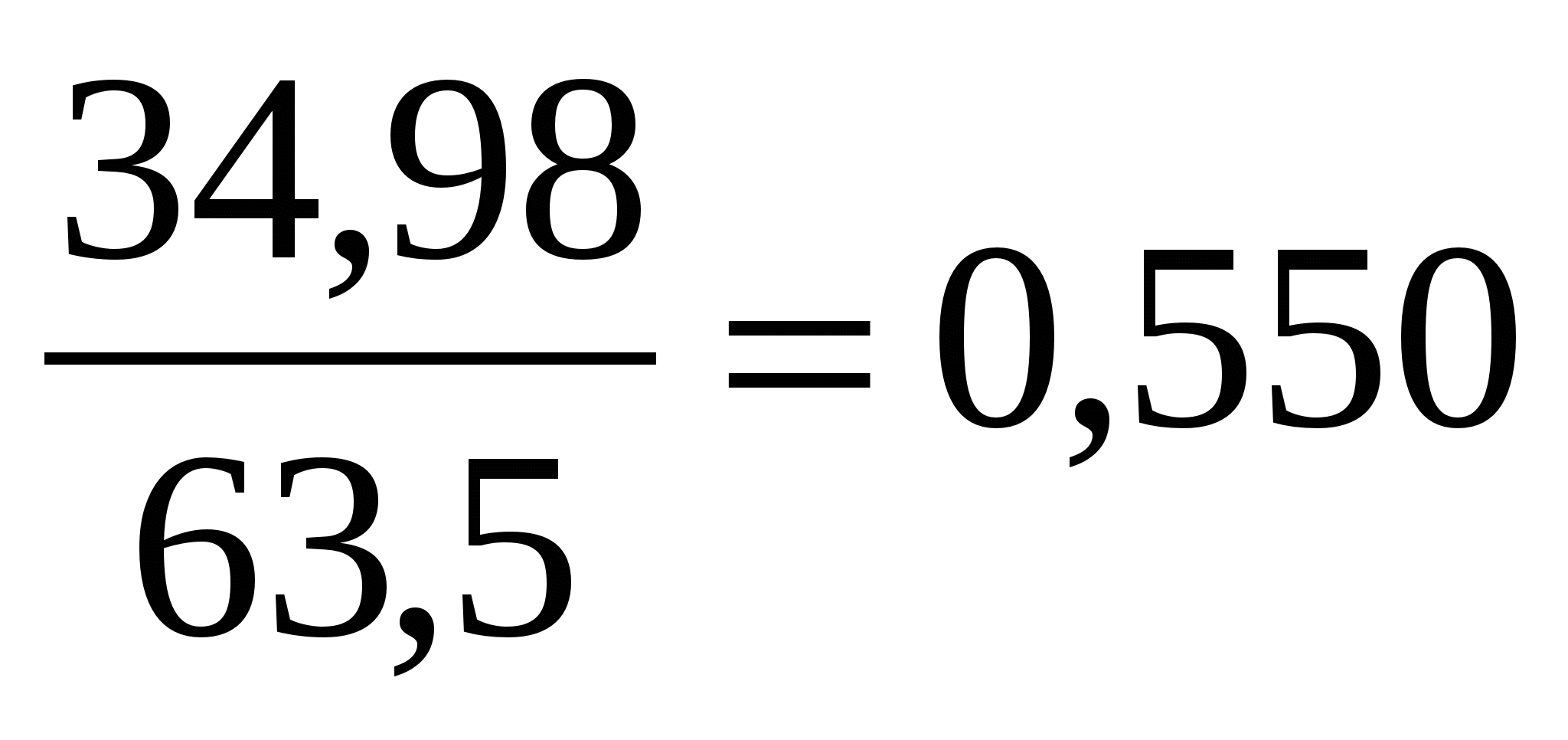 | 1 |
|
| S | 35,75 |  | 2 |
Die Formel von Chalkopyrit drückt seine quantitative Zusammensetzung aus, gibt jedoch keine Vorstellung von den Kombinationen und Verbindungsmethoden zwischen den Elementen. Die Koeffizienten in der chemischen Formel zeigen nur die Beziehung zwischen den Elementen, aus denen dieses Mineral besteht.
Neben chemischen Summenformeln werden auch Strukturformeln verwendet, die nicht nur eine Vorstellung von der chemischen Zusammensetzung, sondern auch von der räumlichen Lage geben
Atome in einem Mineral und ihre Bindungen untereinander. Beispielsweise lautet die Summenformel des Minerals Malachit H 2 Cu 2 CO 5 und die in der Ebene dargestellte Strukturformel:
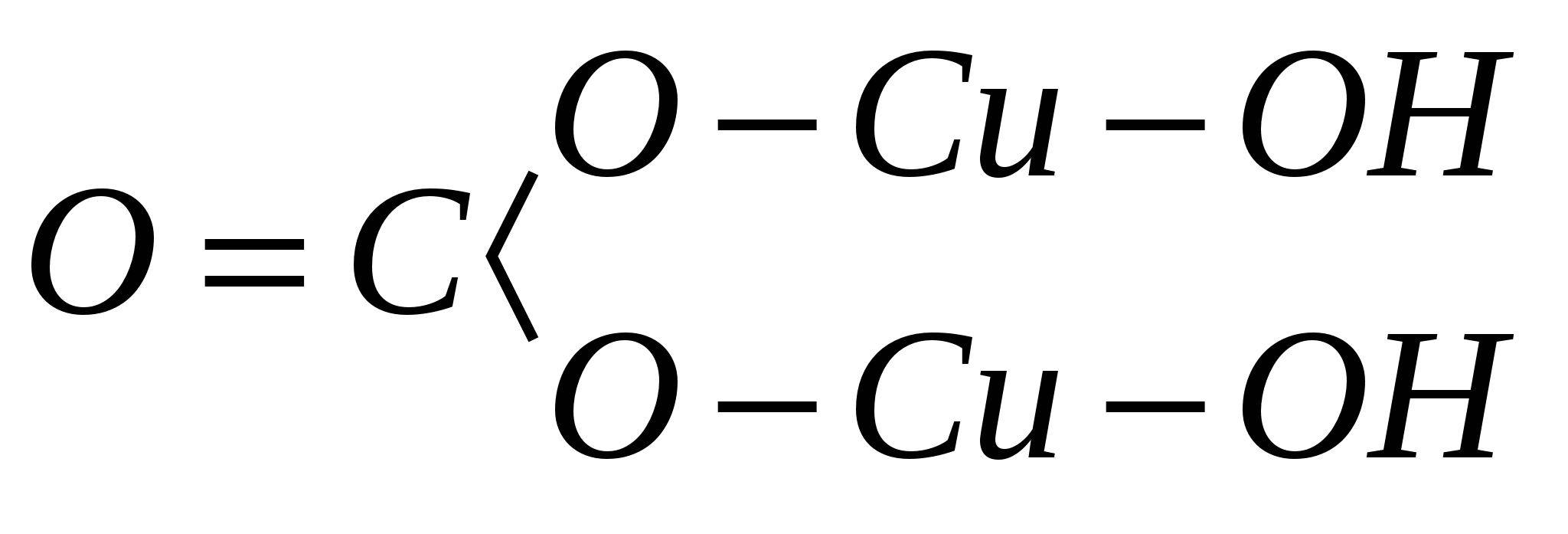
In Anbetracht des Vorstehenden kann die obige Formel für das Mineral Malachit in der folgenden Form geschrieben werden: Cu 2 (OH) 2 CO 3. Aus dieser auf dem Strukturprinzip basierenden Formel folgt, dass Wasser nicht in Form von H 2 O, sondern in Form von Hydroxyl (OH) 1- fest an Kupfer gebunden ist.
Die Röntgenmethode ermöglicht es, die Bindungen zwischen Atomen in den Kristallstrukturen von Mineralien und manchmal auch deren Position im Weltraum aufzudecken. Die Wissenschaft der Kristallchemie befasst sich mit dem Zusammenhang zwischen Chemie und der Struktur eines Stoffes und seiner Eigenschaften.
Derzeit gibt es viele Möglichkeiten, die chemischen Formeln von Mineralien zu schreiben, je nachdem, was genau sie mit der Formel ausdrücken möchten. Beispielsweise charakterisiert die Strukturformel des Orthoklases K[(AlSi 3)O 8 ] die Art der chemischen Verbindung und die gegenseitigen Bindungen zwischen einzelnen Elementen. Um die qualitative Zusammensetzung der wichtigsten Komponenten (Elemente) und ihre quantitativen Verhältnisse widerzuspiegeln, sollte die Orthoklas-Formel in Form von Oxiden K 2 O A1 2 O 3 -6Si0 2 dargestellt werden.
Die chemische Zusammensetzung der meisten Mineralien kann nicht genau durch eine Formel ausgedrückt werden. Sie hängt von verschiedenen mechanischen Verunreinigungen in Mineralien und von der Fähigkeit einiger Verbindungen ab, isomorphe Mischungen oder feste Lösungen zu bilden.
Verunreinigungen können entweder mechanisch, grob, leicht trennbar oder sehr fein, schwer trennbar sein. Das Auftreten von Verunreinigungen tritt aufgrund des Einfangens von Fremdstoffen durch das wachsende Mineral auf. Das Vorhandensein gewöhnlicher grober Verunreinigungen beeinflusst die Formel des Minerals nicht.
Isomorphismus (von griechisch „isos“ – gleich und „morphe“ – Form) ist die Fähigkeit von Stoffen, die in chemischer Zusammensetzung und kristallographischen Eigenschaften ähnlich sind, Mischkristalle zu bilden, d.h. bauen bei der Kristallisation aus Schmelzen oder Lösungen ein gemeinsames Kristallgitter auf. Solche Kristalle nennt man isomorphe Mischungen. Sie haben eine variable Zusammensetzung; andernfalls werden sie feste Lösungen genannt.
Aus chemischer Sicht und der Struktur des Kristallgitters werden zwei Haupttypen von Isomorphie unterschieden: isovalent und heterovalent.
Bei der isovalenten Isomorphie haben sich gegenseitig ersetzende Ionen die gleiche Wertigkeit, im Kristallgitter werden Teilchen gleicher Wertigkeit ersetzt - ein Ion durch ein anderes. Dies ist der einfachste Fall der Bildung von Mischkristallen. Die chemischen Formeln isomorpher Substanzen sind dabei völlig ähnlich und unterscheiden sich nur in einem Ion, meist einem Kation, wie zB bei Olivinen. Im Rautensystem kristallisierende Olivine sind ein isomorphes Gemisch zweier Stoffe: Forsterit Mg 2 und Fayalit Fe 2 , die auch als eigenständige Minerale vorkommen (auch Rautensystem); die Olivinformel lautet: (Mg, Fe) 2 . Das Komma zwischen den Mg 2+ - und Fe 2+ -Ionen in dieser Formel bedeutet, dass sie einander in beliebiger Menge ersetzen können und eine kontinuierliche Reihe von Verbindungen mittlerer Zusammensetzung bilden. Das dominante Element wird normalerweise zuerst platziert.
Komplexer ist der heterovalente Isomorphismus: Im Kristallgitter werden Ionen unterschiedlicher Wertigkeiten ausgetauscht, aber das elektrostatische Gleichgewicht wird wiederhergestellt, so dass die Summe der Wertigkeiten der ersetzenden Paare gleich ist. Ein klassisches Beispiel für eine solche komplexe Substitution sind Mineralien aus der Feldspatgruppe - Plagioklase. Plagioklase sind eine kontinuierliche isomorphe Reihe von Mineralien, die in der triklinen Syngonie kristallisieren, wo ein Paar Ca 2+ Al 3+ -Ionen durch ein Paar Na + Si 4+ ersetzt wird. Die äußersten Mitglieder dieser Reihe - Anorthit Ca [(A1 2 Si 2)O 8] und Albit Na [(A151 3)O 8] - kommen auch als eigenständige Minerale vor. In diesem Fall liegt die gleiche Gesamtwertigkeit der Substituentengruppen (5 und 5) vor; wenn NaSi von der Albitformel und CaAl von der Anorthitformel abgezogen wird, ist der Rest für beide Formeln gleich – AlSi 2 O 8 .
Entsprechend der Änderung der Zusammensetzung ändern sich auch die physikalischen Eigenschaften isomorpher Substanzen. Beispielsweise ändern sich die optischen Eigenschaften von Plagioklasen, was die Grundlage für ihre Diagnose während der kristalloptischen Untersuchung ist. Bei Olivinen ändert sich die Farbe des Minerals von grün nach schwarz, und der Schmelzpunkt sinkt mit zunehmendem Gehalt an Fayalit.
Je nach Vollkommenheitsgrad isomorpher Substitutionen lassen sich zwei Fälle unterscheiden. Im ersten Fall kann der Ersatz eines Elements durch ein anderes bis zu 100% betragen - dies ist ein perfekter oder vollständiger Isomorphismus (Olivine, Plagioklas). Im zweiten Fall kann die Substitution teilweise sein - von Hundertstel bis zu mehreren Prozent. Dies ist ein unvollkommener oder begrenzter Isomorphismus. Calcit Ca [CO 3 ] und Magnesit Mg [CO 3 ] ergeben also nur eine Verbindung mit Zwischenzusammensetzung – Dolomit CaMg [CO 3 ] 2 . Das Fehlen eines Kommas zwischen Ca und Mg in der Dolomitformel weist darauf hin, dass es sich hier um eine chemische Verbindung einer bestimmten Zusammensetzung und nicht um eine isomorphe Mischung handelt.
Elemente, die sich an den Knoten des Kristallgitters gegenseitig ersetzen können (die gleiche Position darin einnehmen), ohne seine Struktur zu verletzen, werden als isomorph zueinander bezeichnet und gehören zu derselben isomorphen Reihe. Das Konzept der isomorphen Reihe von Elementen, die mit dem Periodensystem von Mendeleev verbunden sind, wurde von Akademiker V. I. Vernadsky entwickelt. In verschiedenen thermodynamischen Schalen der Erdkruste sind diese Isomorphenreihen unterschiedlich, d.h. verändern sich unter dem Einfluss von Temperatur und Druck. Warum können Atome oder Ionen eines bestimmten Elements dann Atome (Ionen) von nur einigen und nicht allen Elementen im Kristallgitter ersetzen? Um dies zu verstehen, versuchen Sie sich das Kristallgitter nicht als ein System von Punkten vorzustellen, die durch große leere Lücken getrennt sind (wie ein räumliches Gitter normalerweise dargestellt wird), sondern als ein System sich berührender Kugeln. Jede Kugel ist die Wirkungssphäre eines Atoms (Ions), d.h. ein Raum, in den nach den Gesetzen der Wechselwirkung elektrischer Ladungen andere Atome (Ionen), die von ihren atomaren (ionischen) Sphären umgeben sind, nicht eindringen können.
Somit sind die Abstände zwischen bestimmten Atomen (Ionen) des Gitters unter bestimmten Temperatur- und Druckbedingungen streng konstant und werden durch die Gesetze der Elektrostatik bestimmt. Auch die Radien der Wirkungsbereiche von Atomen (Ionen), Atom-(Ionen-)Radien genannt, sind konstant. (R ich ) 1 .
Die Messung von Atom- und Ionenradien zeigte, dass nur die Elemente, deren Atom-(Ionen-)Radien nahe beieinander liegen, isomorph zueinander sind. Der Unterschied in der Größe der Radien sich gegenseitig ersetzender Ionen sollte 15 % des Radius des kleineren der Ionen nicht überschreiten.
Lassen Sie uns das Gesagte anhand von Beispielen erläutern. Für Karbonate von Magnesit Mg [СО 3] und Siderit Fe [С0 3] ist aufgrund der engen Nähe der Atomradien (Ionenradien) von Magnesium und Eisen eine kontinuierliche isomorphe Reihe bekannt: R ich Mg2+ = 0,74 Å; R ich Re 2+ = 0,80 Å. Die Mitglieder dieser Reihe können durch die Formel (Mg, Fe) [CO 3 ] oder (Fe, Mg) [CO 3 ] ausgedrückt werden; hier zeigt das Komma an, dass sich die Mg- und Fe-Ionen wie Atome desselben Elements verhalten. Aber für Halit NaCl und Sylvin KS1, die in der kubischen Syngonie kristallisieren, werden mit der Analogie der chemischen Zusammensetzung keine isomorphen Beziehungen beobachtet (bei gewöhnlicher Temperatur), da die Größen ihrer Ionenradien sehr unterschiedlich sind ( R ich Ma + = 0,98 Å und R ich K + = 1,33 Å).
Das Phänomen der isomorphen Substitutionen bleibt unter verschiedenen äußeren Bedingungen nicht unverändert. Bei hohen Temperaturen verläuft die Substitution leichter, und viele Substanzen, die bei gewöhnlichen Temperaturen nicht isomorph sind, werden bei hohen Temperaturen isomorph. Zum Beispiel alkalisch Feldspäte bilden die Orthoklase K [(À1Si 3)Þ 8 ] und Albit Na [(À1Si 3)Þ 8 ] bei der Kristallisation aus Magma eine kontinuierliche isomorphe Reihe (К, Na) [(À1Si 3)0 8 ], aber dann als die sinkt, so zerfällt das isomorphe Gemisch im festen Zustand wieder in zwei eigenständige Minerale: eines mit überwiegendem Kaliumgehalt - Orthoklas und das andere mit überwiegendem Natriumgehalt - Albit. Dieses Phänomen wird als Zersetzung fester Lösungen bezeichnet.
1 Ionenradien (Atomradien) werden in Angström (Å) gemessen; 1 Å = 10-8 cm.
Die meisten Mineralien enthalten isomorphe Verunreinigungen in unterschiedlichen Mengen. Die wichtigsten und häufigsten Silikatgruppen (Olivin, Pyroxene, Amphibole, Feldspäte) sind isomorphe Mischungen.
Die Isomorphie hilft, die Ursachen zahlreicher Elementassoziationen in der Erdkruste zu verstehen, und ermöglicht es, in einer Reihe von Fällen das Vorhandensein bestimmter kommerziell wertvoller seltener (verteilter) Elemente in vielen weit verbreiteten Mineralien vorherzusehen. So wird beispielsweise Germanium durch Silizium, Cäsium, Rubidium - durch Kalium usw. - maskiert.
Polymorphie (von griechisch „poly“ – viele und „morphe“ – Form), oder Vielgestaltigkeit, ist die Fähigkeit eines Stoffes, bei gleicher chemischer Zusammensetzung in verschiedenen verwandten Strukturen zu kristallisieren verschiedene Arten Symmetrie oder Syngonie. Unterschiedliche Sorten derselben Substanz mit unterschiedlicher Struktur unterscheiden sich in ihren Eigenschaften. Sie sind Mineralien - polymorphe Varianten (Modifikationen) einer bestimmten Substanz. Ihr Auftreten erklärt sich aus den unterschiedlichen physikalisch-chemischen Bedingungen ihrer Entstehung (Temperatur, Druck) und der Beschaffenheit der Umgebung. Polymorphe Varietäten derselben chemischen Verbindung erhalten unterschiedliche Namen oder werden mit den Buchstaben des griechischen Alphabets α, β, γ bezeichnet.
Das klassische Beispiel für Polymorphismus ist Kohlenstoff. Es kristallisiert in zwei Systemen: kubisch - Diamant und hexagonal - Graphit. Die Eigenschaften dieser beiden Mineralien sind sehr unterschiedlich. Diamant zeichnet sich durch seine hohe Härte aus, ist das härteste aller uns bekannten Mineralien, leitet keinen Strom. Seine farblosen und transparenten Kristalle haben einen ungewöhnlich starken Glanz.
Graphit hat ganz andere Eigenschaften. Seine Härte ist gering (Graphitstifte), splittert leicht in Flocken, leitet gut elektrischer Strom. Graphit-Aggregate zeichnen sich durch ihre Opazität und schwarze oder stahlgraue Farbe aus.
Auch ihre Dichten unterscheiden sich stark: Diamant hat eine Dichte von 3,5 - 3,6, Graphit hat eine Dichte von 2,2.
Diamant wird bei hoher Temperatur und sehr gebildet hoher Druck, in großen Tiefen im Erdinneren, Graphit - in geringerer Tiefe, bei niedrigeren Temperaturen und Drücken.
Der Grund für die unterschiedlichen Eigenschaften von Diamant und Graphit liegt in ihrer Struktur, d.h. Anordnung von Kohlenstoffatomen. In Graphit ist die Bindung von Kohlenstoffatomen weniger stark als in Diamant. Die Struktur von Graphit ist durch eine dichte Anordnung von Kohlenstoffatomen in parallelen Ebenen gekennzeichnet (Abb. 25). In jeder Schicht befinden sich Atome an den Ecken regelmäßiger Sechsecke, und zwischen ihnen besteht eine starke Bindung. In vertikaler Richtung sind die Schichten durch große Abstände voneinander getrennt und die Verbindung zwischen ihnen ist schwächer. Polymorphismus von Mineralien, die sind chemische Elemente(Kohlenstoff, Schwefel etc.) nennt man Allotropie. Die hexagonalen, rhombischen und monoklinen Modifikationen von Schwefel sind gut bekannt.
Komplexere Formationen finden sich auch in Form verschiedener polymorpher Sorten: CaCO 3, FeS 2 usw.
Der Übergang von einer polymorphen Sorte (Modifikation) zu einer anderen, beispielsweise verursacht durch eine Temperaturänderung, erfolgt abrupt, mit einer Umstrukturierung der Struktur bei einer bestimmten Eigenschaft dieser Sorte (wenn der Druck unverändert bleibt) und wird begleitet von die Abgabe oder Aufnahme von Wärme.
Der Polyformismus von Kieselsäure (SiO 2 ) ist gut untersucht, die drei Hauptsorten bildet: Quarz, Tridymit und Cristobalit, von denen jede mehrere Modifikationen aufweist. Quarz, der nur bis 573 °C stabil ist, geht bei Temperaturerhöhung sukzessive in eine Reihe von polymorphen Modifikationen über:
Die Kenntnis der Temperaturen der polymorphen Umwandlungen von Quarz wird für praktische Zwecke genutzt (um beispielsweise Tridymit zu erhalten, ein feuerfestes Material, das im Temperaturbereich von 870 bis 1470 ° C keine Umwandlungen durchläuft, wird Quarz auf eine Temperatur über 870 ° C vorgewärmt C).
Das Vorhandensein von polymorphen Modifikationen in Kieselsäure macht es möglich, es als geologisches "Thermometer" zu verwenden. Durch Auffinden der einen oder anderen polymorphen Modifikation unter Felsen und Aderablagerungen können wir die Temperaturintervalle abschätzen, in denen die Entstehung des Gesteins stattfand.
Zur Bildung einer polymorphen Vielfalt eines Stoffes sind bestimmte Temperatur- und Druckintervalle erforderlich. Bei einer Änderung dieser Parameter wird sie instabil und sollte theoretisch im Laufe der Zeit zu einer Sorte werden, die unter neuen Bedingungen stabil ist. Aufgrund der sehr geringen Umlagerungsgeschwindigkeit des Kristallgitters bei niedrigen Temperaturen können jedoch unter gleichen Bedingungen nahezu unendlich lange polymorphe Varianten eines Stoffes existieren: die eine in einem stabilen Zustand, die andere in einem relativ instabilen Zustand (z Beispiel Diamant auf der Erdoberfläche).
Wir haben oben bereits erwähnt, dass die überwiegende Mehrheit der natürlich vorkommenden Mineralien chemische Verbindungen sind. Zu letzteren gehören:
- a) sicher Anschlüsse, sowohl einfach als auch doppelt, und
- b) Verbindungen variable Zusammensetzung.
Auch weit verbreitet feste Lösungen, oder die sog isomorphe Mischungen. Feste Pseudolösungen müssen von diesen echten festen Lösungen unterschieden werden, genauso wie diese Unterscheidung bei flüssigen Lösungen gemacht wird.
Abschließend ist besonderes Augenmerk zu richten Wasserverbindungen, deren Vorstellungen in den letzten Jahren deutlich verfeinert wurden.
Bestimmte Verbindungen. Alle bestimmten chemischen Verbindungen gehorchen bekanntlich streng dem Gesetz der Konstanz der Zusammensetzung, ausgedrückt durch chemische Formeln, dem Gesetz der multiplen Verhältnisse und dem Gesetz der Anteile, das die Verhältnisse der Komponenten einer bestimmten Verbindung mit ihren Verhältnissen in anderen verbindet Arten von Verbindungen. Diese Gesetze stehen in voller Übereinstimmung mit dem Periodensystem der Elemente von D. I. Mendeleev, den Gesetzen der Kristallchemie und der Symmetrielehre in kristallinen Medien.
Es ist charakteristisch, dass sich diese Verbindungen durch eine Reihe besonderer physikalischer Eigenschaften auszeichnen, die in den physikalisch-chemischen Diagrammen von Schmelzpunkt, Löslichkeit, elektrischer Leitfähigkeit, Härte, spezifischem Gewicht, Brechungsindizes usw. deutlich sichtbar sind.
Bestimmte chemische Verbindungen umfassen:
- Oxide (Cu 2 O, MgO, Fe 2 O 3, SiO 2 usw.),
- verschiedene Sauerstoffsalze (CaCO 3, CaSO 4, AlBO 3, Mg 2 SiO 4 usw.),
- Sulfide (NiS, FeS 2, Sb 2 S 3 usw.),
- Halogenverbindungen (NaCl, AgBr, CaF 2 usw.) usw.
Die chemische Zusammensetzung chemischer Verbindungen kann auf zwei Arten dargestellt werden:
- in Form von empirischen Formeln und
- in Form von Konstitutions- oder Strukturformeln.
Empirische Formeln drücken die Zusammensetzung von Mineralien entweder in Form von Elementen aus, die in der Verbindung enthalten sind (z. B. BaSO 4, Na 3 AlF 6, NaAlSi 3 O 8 usw.), oder in Form einer Reihe einfachster konstituierender Verbindungen BaO SO 3, 3NaF AlF 3, Na 2 O Al 2 O 3 6SiO 2 usw.). Letztere Art von Formeln entspricht zwar nicht den modernen Vorstellungen über die Natur chemischer Verbindungen, hat aber den Vorteil, dass sie das Erinnern an die Zusammensetzung von Mineralien erleichtert.
Signifikante Korrekturen im Umriss der Formeln komplexerer Verbindungen werden durch kristallchemische Daten auf der Grundlage der Röntgenbeugungsuntersuchung von Mineralien vorgenommen. Da die meisten anorganischen kristallinen Substanzen durch ionische Bindungen von Struktureinheiten gekennzeichnet sind, ist es wichtig, diese Strukturelemente (Ionen und Komplexe), die in verschiedenen Arten von kristallinen Strukturen etabliert sind, in den Formeln chemischer Verbindungen widerzuspiegeln. Anionische Komplexe werden in diesem Fall normalerweise durch eckige Klammern von Kationen getrennt, z. B. Mg 2, Ca 3 2, Mg 2, Na usw.
Doppelte Verbindungen. Neben einfachen chemischen Verbindungen kommen in der Natur häufig Doppelverbindungen vor, insbesondere Doppelsalze. Doppelsalze sind solche speziellen Verbindungen, die gleichsam aus zwei einfachen Salzen bestehen, die in mehreren Verhältnissen vorliegen. In den meisten Fällen liegen diese Salze doppelt in Kationen, seltener in Anionen oder gleichzeitig in Kationen und Anionen vor. Als Beispiele seien genannt: CaMg 2 , K 3 Na 2 usw.
Beim Vergleich der Formeln von Doppelsalzen stellt sich heraus, dass die in ihrer Zusammensetzung enthaltenen Kationen aufgrund des signifikanten Unterschieds in ihren Ionenradien einander nicht isomorph ersetzen können: Ca 2+ (1,01, Å) und Mg 2+ (0,75 Å ), K 1+ (1,33 Å) und Na 1+ (0,98 Å) usw. Daher ist es nicht überraschend, dass sie sich von ihren einfachen Salzen in einigen Merkmalen von Kristallstrukturen und häufig physikalischen Eigenschaften unterscheiden.
Verbindungen variabler Zusammensetzung. Neben bestimmten chemischen Verbindungen gibt es etliche solcher Verbindungen, deren Zusammensetzung nicht konstant ist, sondern in engen oder weiteren Grenzen schwankt und diese Schwankungen in der Zusammensetzung nicht durch mechanische Verunreinigungen durch Fremdstoffe zu erklären sind. Im Gegenteil, die schwankende Zusammensetzung von Verbindungen aus kristallchemischer Sicht findet eine Erklärung in der begrenzten Löslichkeit der konstituierenden Komponenten in einer gegebenen Verbindung. Solche chemischen Formationen werden als Verbindungen variabler Zusammensetzung bezeichnet.
Unter den Mineralien sind Verbindungen unterschiedlicher Zusammensetzung ziemlich zahlreich. Unter ihnen sind vor allem solche Doppelsalze zu nennen, bei denen ihre einfachen Salze, obwohl sie ähnlich aufgebaute Kristallgitter haben, aufgrund stark unterschiedlicher Ionenradien oder aufgrund unterschiedlicher Polarisationseigenschaften keine vollständige Isomorphie aufweisen . Sie zeichnen sich daher durch eine partielle Schwankung der Zusammensetzung aus, die sich in ungenauer Übereinstimmung mit ihren chemischen Formeln mit streng stöchiometrischen Verhältnissen der Komponenten ausdrückt.
Geringe Mengen an isomorphen Verunreinigungen anderer Komponenten finden sich in sehr vielen einfachen und komplexen Verbindungen. Dazu gehört beispielsweise Sphalerit (ZnS), bei dem der Eisengehalt in Form einer isomorphen Verunreinigung mehrere Prozent erreicht. Zahlreiche andere Beispiele werden in der Beschreibung von Mineralien gegeben.
Chemische Verbindungen variabler Zusammensetzung unterscheiden sich in ihren Eigenschaften nicht von festen Lösungen und sind als solche zu betrachten, jedoch mit eingeschränkter Mischbarkeit der Komponenten.
Solide Lösungen. Die Fähigkeit kristalliner Substanzen unterschiedlicher Zusammensetzung, Mischungen derselben kristallinen Struktur zu bilden, die sich ständig in ihrer Zusammensetzung ändern, basiert weitgehend auf Isomorphie, dh der Eigenschaft von Elementen, sich in chemischen Verbindungen ähnlicher Zusammensetzung auszutauschen.
Isomorphismus zweier Substanzen liegt vor, wenn sie eine ähnliche chemische Formel haben und wenn die entsprechenden Ionen beider Substanzen das gleiche Ladungszeichen haben und die Größe der Ionen und ihr Polarisationsgrad bekannte Grenzen nicht überschreiten, d.h. sie sind es mit einer gewissen Genauigkeit gleich.
BEI natürliche Bedingungen, zum Beispiel weit verbreitet isovalent Isomorphismus von Mg 2+ (Ionenradius 0,75 Å) mit zweiwertigen Ionen Fe 2+ (0,79 Å), Ni 2+ (0,74 Å), Co 2+ (0,77 Å), Zn 2+ (0,79 Å) und Mn 2 + (0,91 Å). Ein weiteres Beispiel ist die Isomorphie dreiwertiger Ionen: Fe 3+ (0,67 Å), Cr 3+ (0,64 Å), Al 3+ (0,57 Å), Mn 3+ (0,70 Å), V 3+ (0,65 Å), Ti 3 + (0,69 Å). Gleiches gilt für komplexe Struktureinheiten, die am Aufbau von Kristallgittern beteiligt sind, z. B. 2-, 2- usw.
Damit einhergehend wurde jedoch festgestellt und experimentell bestätigt, dass bei der Bildung von Mineralien variabler Zusammensetzung in kristallinen Strukturen nicht nur einfache Ionen (oder Atome) durch andere, gleichwertige Ionen (oder Atome) ersetzt werden können, sondern auch ganze Gruppen von Ionen können durch Gruppen anderer Ionen einer anderen Wertigkeit, aber mit der gleichen Summe aller Wertigkeiten ersetzt werden. Dieser Fall heißt heterovalent Isomorphismus. So ist zB die Isomorphie in der Reihe der Plagioklase, wo die NaAlSi 3 O 8 -Gruppe in den unterschiedlichsten Verhältnissen durch die CaAl 2 Si 2 O 8 -Gruppe unter Bildung von Kristallen der gleichen Symmetrieklasse ersetzt werden kann. Im Wesentlichen haben wir hier den Ersatz von Na 1+ Si 4+ durch Ca 2+ Al 3+ .
Bei der heterovalenten Isomorphie spielen nach wie vor die Größen der sich gegenseitig ersetzenden Struktureinheiten (Atome, Ionen, ionische Komplexe) eine entscheidende Rolle: Sie müssen in etwa gleich sein. Der Unterschied in den Radien von Komponenten, die einander ersetzen, überschreitet, wie Vergleiche zeigen, normalerweise nicht 15 % des kleineren Radius.
Wie wir wissen, nehmen die Ionenradien in den vertikalen Gruppen des Periodensystems der Elemente mit zunehmender Ordnungszahl zu und in horizontaler Richtung mit zunehmender Gruppenzahl (d. h. mit zunehmender Wertigkeit) ab. Auf dieser Grundlage leitete A. E. Fersman das Gesetz der diagonalen Reihen isomorpher Ionen im Periodensystem der Elemente ab, das für dessen linke Seite gilt. Die folgenden isomorphen Reihen heterovalenter Ionen sind skizziert (Ionenradien in Angström sind in Klammern angegeben):
- Li 1+ (0,69) -Mg 2+ (0,75) -Sc 3+ (0,81) -Zr 4+ (0,82)
- Na 1+ (0,98) -Ca 2+ (1,01) -Y 3+ (1,06)
- K 1+ (1.33) -Sp 2+ (1.27)
- Rb 1+ (1,48)-Ba 2+ (1,36)
- Al 3+ (0,57) -Ti 4+ (0,65) -Nb 5+ (0,70)
Tatsächlich beobachten wir in natürlichen Verbindungen häufig, dass beispielsweise Lithiummineralien isomorphe Magnesiumverunreinigungen, Magnesiummineralien - Scandiumverunreinigungen, Natriummineralien - Calciumverunreinigungen, Calciummineralien - Yttriumverunreinigungen usw. enthalten.
Außerdem kann in komplexen Anionen das 4-Ion durch 5-, 3- und 2-Ionen ersetzt werden, die die gleiche oder ähnliche Größe haben. Bei Beispielen für das Gesagte werden wir bei der Beschreibung von Mineralien mehr als einmal aufhören.
Aus genetischer Sicht ist es wichtig, zwischen zwei Arten von festen Lösungen zu unterscheiden:
- echte feste Lösungen und
- feste Pseudolösungen.
Echte solide Lösungen, oder wie sie auch genannt werden, isomorphe Mischungen *, sind in der Kristallstruktur völlig homogene Mischungen in beliebigen Verhältnissen von zwei oder mehr Stoffen, die keine chemischen Verbindungen eingehen. Beispiele sind feste Lösungen von Gold und Silber, Mangan- und Eisenwolframate, Plagioklase usw.
* (In der Literatur findet sich auch ein Synonym für „Mischkristalle“ (wörtlich übersetzt aus deutsche Sprache). Der Titel ist nicht ganz korrekt.)
Die physikalischen und chemischen Eigenschaften fester Lösungen sind additiv*, d.h. sie ändern sich allmählich und regelmäßig mit steigendem Gehalt der zweiten Komponente. Dies sind zum Beispiel die Änderung von Schmelzpunkt, spezifischem Gewicht, Brechungsindizes, Reflexionsvermögen, elektrische Leitfähigkeit etc. Änderungen all dieser Eigenschaften sind in den Diagrammen als Geraden (z spezifisches Gewicht) oder sanft gekrümmte Kurven (Schmelzpunkte, optische Eigenschaften usw.). Diese Kurven für isomorphe Reihen sind so charakteristisch, dass nach der Gesamtheit der untersuchten Eigenschaften keine gegeben ist mineralischer Typ sie können verwendet werden, um seine Zusammensetzung zu bestimmen, ohne auf eine chemische Analyse zurückzugreifen. Beispielsweise ist es nicht schwierig, die Zusammensetzung von Plagioklas auf diese Weise anhand spezieller Diagramme zu bestimmen, indem seine optischen Eigenschaften in dünnen Schnitten unter dem Mikroskop untersucht werden.
* ("Addo" - hinzufügen)
Es gibt zwei Arten von echten festen Lösungen:
- a) Substitutionsmischkristalle (oder Lösungen erster Art) und
- b) interstitielle feste Lösungen (oder Lösungen der zweiten Art).
a) Substitutionsmischkristalle sind besonders charakteristisch für Metalle und ionische Verbindungen. Ihre Essenz läuft darauf hinaus, dass in Verbindungen mit ähnlich aufgebauten Kristallgittern Atome oder Ionen einer Verbindung durch andere ersetzt werden (dh an die Stelle anderer treten). Dies sind beispielsweise isomorphe Reihen: ZnCO 3 -FeCO 3, MnWO 4 -FeWO 4 usw.
b) Interstitielle Mischkristalle zeichnen sich dadurch aus, dass sich die zweite Komponente nur in Hohlräumen befindet, also in den Lücken zwischen den Atomen oder Ionen, die das Kristallgitter der ersten Komponente bilden. Eine solche feste Lösung kann nur unter der Bedingung stattfinden, dass die Größen der Atome (Ionen) beider Komponenten sich stark voneinander unterscheiden. Das charakteristischste Beispiel für diese Art von fester Lösung ist eine Lösung von Kohlenstoff in Eisen, die sich leicht bei hohen Temperaturen bildet und sich bei langsamer Abkühlung in Eisen und Eisencarbid (Fe 3 C) zersetzt.
In den chemischen Formeln fester Lösungen werden isomorphe Atome oder Ionen in Klammern gesetzt, durch Kommas voneinander getrennt und in absteigender Reihenfolge des Inhalts angeordnet: (Au,Ag), (Zn,Fe)S, (Zn,Fe)CO 3, (Fe ,Mn)WO 4 usw. Geringere isomorphe Verunreinigungen sind in der Formel entweder gar nicht oder kleingedruckt eingetragen. Wenn in einem Doppelsalz eine der Komponenten isomorphe Verunreinigungen enthält, dann wird die Formel wie folgt dargestellt: Ca(Mg,Fe) 2 .
Solide Pseudolösungen sie unterscheiden sich von den echten dadurch, dass sie feinverteilte Verunreinigungen von Fremdstoffen enthalten, deren Vorhandensein sich aufgrund der Gesetze der Kristallchemie nicht erklären lässt. Beispiele für feste Pseudolösungen sind Kristallsole (S. 39), insbesondere solche farbigen durchscheinenden Mineralien wie Rosenquarz, roter Calcit, schwarzer Sphalerit usw., die völlig homogen zu sein scheinen (das Farbpigment ist so fein darin verteilt Sie).
Wasseranschlüsse. Zunächst müssen wir folgende wichtige Bemerkung machen. Wässrige Verbindungen sollten nur solche umfassen, die in ihrer Zusammensetzung elektrisch neutrale Verbindungen enthalten. Wassermoleküle. Früher wurden unter dem Deckmantel der Wasserverbindungen auch Mineralien mit Hydroxyanionen [OH] 1- in Betracht gezogen. Allerdings besteht zwischen dem H 2 O-Molekül und dem negativ geladenen [OH] 1- -Ion natürlich ein grundlegender Unterschied, der sich ganz erheblich auf die physikalischen und physikalischen Eigenschaften auswirkt chemische Eigenschaften Mineralien. Hydroxyl kann als Ion Anionen wie F 1-, Cl 1- in Verbindungen ersetzen und wird fest in Kristallgittern gehalten. Das H 2 O-Molekül hat diese Eigenschaft nicht und wird, da es schwach im Gitter gebunden ist, beim Erhitzen leicht entfernt. Die Tatsache, dass Hydroxyl beim Kalzinieren von es enthaltenden Mineralien beim Verlassen des Kristallgitters in Wasserdampf übergehen kann, kann auf keinen Fall als Grundlage für eine Identifizierung mit dem H 2 O-Molekül dienen und ist daher sehr wichtig Geben Sie getrennt das Vorhandensein von Hydroxyl und Wasser in den chemischen Formeln von Mineralien an. Aus dieser Sicht ist beispielsweise Malachit - Cu 2 2 kein Wasser, sondern das hauptsächliche wasserfreie Kupfercarbonat, obwohl in der chemischen Analyse das Hydroxyl in Form von H 2 O bestimmt wird. Dasselbe gilt für Mineralien, die saure Salze sind , bei dem sich unter den Kationen Wasserstoff befindet.
Abhängig davon, wie Wasser in Mineralien gehalten wird, gibt es:
- Kristallisation oder gebundenes Wasser, das in den Kristallgittern von Mineralien enthalten ist, und
- freies Wasser, das nicht am Aufbau der kristallinen Substanz selbst beteiligt ist
gebundenes Wasser nimmt am Gitter in Form von H 2 O-Molekülen teil und nimmt darin genau definierte Plätze ein. Die Anzahl der Wassermoleküle steht in einfachen Verhältnissen zu den anderen Bestandteilen der Verbindung. Als Beispiele seien genannt: Na 2 CO 3 10H 2 O (Soda), CaSO 4 2H 2 O (Gips), Ni 3 2 8H 2 O (Annabergit), Al 2 3 5H 2 O (Wavellit) usw. Dies ist so -genannt kristalline Hydrate, die nach Werner als "Komplexverbindungen" anzusehen sind, also solche, bei denen sich Wassermoleküle als Struktureinheiten in einer bestimmten Koordination um einige Ionen befinden und somit eine Art Komplexionen bilden.
So haben Röntgenuntersuchungen in der Kristallstruktur der NiSO 4 6H 2 O-Verbindung ergeben, dass sechs Dipol-H 2 O-Moleküle das Ni 2+ -Kation direkt umgeben und offensichtlich in einer bestimmten Weise in Bezug auf das Kation orientiert sind (zwei H 1+ Protonen zur Peripherie des komplexen Ions). Da das H 2 O-Molekül selbst elektrisch neutral ist, behält das hydratisierte 2+-Kation die Ladung von Ni 2+ . Deshalb chemische Formel Verbindungen sollten so geschrieben werden:
Auf die Frage nach dem Grund für die Hydratation von Ionen in Kristallgittern werden wir später eingehen (in der Einführung zu Sauerstoffsalzen). Hier kann nur darauf hingewiesen werden, dass die Notwendigkeit der Hydratation der Ionen streng kristallochemisch begründet ist; für die Bildung stabiler Kristallgitter aus so großen Anionen wie 2- sind die in der Lösung vorhandenen Ni 2+ -Kationen zu klein, weshalb man deren Volumen vergrößern möchte, ohne die Ladung zu ändern. Es versteht sich von selbst, dass die Bildung kristalliner Hydrate nur in wasserreichen Medien erfolgen kann, und zwar bei niedrige Temperaturen.
Beim Erhitzen werden kristalline Hydrate leicht dehydriert, wenn nicht sofort vollständig, dann abrupt, wobei periodisch einige der Wassermoleküle verloren gehen. In diesem Fall erfolgt die Umordnung des Gitters unter Erhaltung rationaler Verhältnisse zwischen der Anzahl der H 2 O-Moleküle und der Hauptverbindung. Beispielsweise bildet Chalcanthit (CuSO 4 · 5H 2 O) bei künstlicher Entwässerung zuerst CuSO 4 · 3H 2 O, dann CuSO 4 H 2 O und schließlich CuSO 4 . Gleichzeitig ändern sich auch physikalische Eigenschaften wie Brechungsindizes, spezifisches Gewicht etc. schlagartig. verschiedene Verbindungen Wasser wird bei verschiedenen Temperaturen entfernt: Einige von ihnen verlieren es bei Raumtemperatur (mehrwertige Kupfer- und Eisensulfate), andere bei höheren Temperaturen und sogar bei Temperaturen über 100 °.
kostenloses Wasser, das in Mineralmassen vorhanden ist, zeichnet sich dadurch aus, dass es nicht direkt am Aufbau des Kristallgitters von Mineralien beteiligt ist. Beim Erhitzen wird es allmählich freigesetzt. Es gibt drei Arten von freiem Wasser:
- a) Zeolith
- b) kolloidal und
- c) hygroskopisch
Zeolithwasser erhielt seinen Namen vom allgemeinen Namen einer speziellen Gruppe von Mineralien - Zeolithen, in denen sich die Merkmale seiner Anwesenheit am deutlichsten manifestieren. Es wurde festgestellt, dass Wassermoleküle in dieser Gruppe von Mineralien keine genau definierte Position im Kristallgitter einnehmen, sondern sich nur in freien Hohlräumen darin befinden (entlang Kanälen, in Zwischenschichträumen usw.). Daher ist die "Löslichkeit" von Wasser in ihnen erheblich eingeschränkt. Es ist interessant, dass sich die Wassermenge in ihnen ändern kann, ohne die kristalline Homogenität der Substanz mit einer allmählichen Änderung der physikalischen Eigenschaften zu verletzen: Transparenzgrad, Brechungsindizes, spezifisches Gewicht usw. Dies zeigt an, dass Wasser sozusagen ist , in einem Zustand einer festen Lösung. Beim Erhitzen wird es im Bereich von 80-400° freigesetzt. Es ist merkwürdig, dass Zeolithe, die durch vorsichtiges Erhitzen dehydriert wurden, wieder Wasser aufnehmen können, wobei ihre früheren physikalischen Eigenschaften wiederhergestellt werden.
Kolloidales Wasser ist, wie der Name schon sagt, in Hydrogelen weit verbreitet, wo es durch sehr schwache Bindungskräfte an der Oberfläche dispergierter Phasen (S. 37) gehalten wird. Es ist im Wesentlichen Adsorptionswasser, und seine Anwesenheit hängt nicht vom Gitter des Adsorptionsmittels ab (das Adsorptionsmittel selbst kann natürlich kristallchemisch gebundenes Wasser enthalten). Ein Beispiel ist Opal (Silica-Hydrogel) - SiO 2 aq (aq sind die ersten beiden Buchstaben des lateinischen Wortes "aqua" - Wasser). Diese von einigen Autoren übernommene Bezeichnung für kolloidales Wasser sollte als rational anerkannt werden.
Hygroskopisches (kapillares) Wasser wird durch Oberflächenspannungskräfte in dünnen Rissen, Poren und pulvrigen Massen gehalten. Zum größten Teil lässt es sich leicht entfernen, wenn es auf 100-110 ° erhitzt wird. Eine scharfe Grenze zwischen kapillarem und kolloidalem Wasser kann nicht gezogen werden.
Um die chemische Zusammensetzung des Minerals zu bestimmen, wird seine chemische Analyse durchgeführt und die chemische Formel des Minerals bestimmt. Formeln können empirisch sein und nur die chemische Zusammensetzung zeigen, und strukturell sein und eine Vorstellung von der räumlichen Anordnung von Atomen in einem Mineral und ihrer Beziehung zueinander geben. Für einige Mineralien wurden noch keine Strukturformeln aufgestellt. Aber dank Röntgenforschungsmethoden war es in vielen Fällen möglich, die Beziehung von Atomen in den Kristallstrukturen von Mineralien zu bestimmen. Diese Fragen des Zusammenhangs der Chemie mit dem Aufbau der Materie und ihren Eigenschaften behandelt die Kristallchemie.
In Mineralien ist es wichtig, Kationen und anionische Komplexe zu identifizieren, die die Arten von Kristallstrukturen charakterisieren. Beim Schreiben von Mineralformeln werden anionische Komplexe von Kationen durch eckige Klammern getrennt, z. B. Siderit Fe. Es ist zu beachten, dass die empirischen Formeln von Mineralien nicht die Merkmale ihrer inneren Struktur widerspiegeln und in der Mineralogie derzeit durch sie ersetzt werden Strukturformeln. Die empirische Formel des Minerals Muskovit ist also H 2 KAl 3 Si 3 O 12 und die Strukturformel ist KAl 2 (OH,F) 2. Letzteres zeigt, dass es in der Struktur von Muskovit einen komplexen anionischen Komplex gibt und dass Wasser in Muskovit nicht in Form von H 2 O vorliegt, sondern in Form von Hydroxyl (OH) – , und dieses Hydroxyl wiederum durch ersetzt werden kann F - .
In der Mineralogie wird häufig zwischen wasserfreien und wässrigen Mineralien (Sulfate, Phosphate, Carbonate etc.) unterschieden. Zu den Wassermineralien gehören solche Mineralien, die elektrisch neutrale Wassermoleküle enthalten. Wasser in der Zusammensetzung von Mineralien kann gebunden und frei sein. Gebundenes oder kristallisiertes Wasser tritt in das Kristallgitter von Mineralien ein und nimmt bestimmte Plätze darin ein. Beispiele sind bestimmte Carbonate und Sulfate, wie Gips. Freies Wasser ist am Aufbau des Kristallgitters von Mineralien nicht beteiligt, seine Menge kann beispielsweise je nach Temperatur unterschiedlich sein. Beispiele für freies Wasser sind Zeolithwasser. Und natürlich ist auch alles hygroskopische Wasser, das in mikroskopisch kleinen Rissen in Mineralien und Gesteinen durch Oberflächenspannungskräfte festgehalten wird, frei. Es wird durch Erhitzen auf 110°C entfernt. Hydroxylhaltige Mineralien im engeren Sinne können nicht als Wassermineralien bezeichnet werden. Zwischen dem elektrisch neutralen Wassermolekül H 2 O und dem negativ geladenen Hydroxyl-Ion (HO) besteht ein grundlegender Unterschied. Hydroxyl (HO) – kann Ionen wie Cl – und Fe – in Mineralien ersetzen, es wird fest in Kristallgittern gehalten, und Wassermoleküle besitzen diese Eigenschaften nicht.
Aufgabe 3. Das Studium der Formen natürlicher Ausscheidungen von Mineralien.
Morphologie von Mineralien und Aggregaten. Zwillinge
Verwachsungen von Kristallen
Für einige Mineralien (Feldspat, Rutil, Kassiterit, Aragonit, Zinnober und viele andere) ist die Bildung nicht nur von Einkristallen, sondern auch von deren Zwillingsverwachsungen - Zwillingen - charakteristisch. In echten, nicht zufälligen Spleißen wachsen Individuen entlang der gleichen flachen Gitter ihrer räumlichen Gitter zusammen. Geometrisch lassen sich Individuen in einem Doppel gedanklich entweder durch Spiegelung in der Symmetrieebene oder durch Drehung um die Achse miteinander verbinden L 2. Doubles können aus einem Kristallpaar (einfach) oder aus sich mehrfach wiederholenden Individuen bestehen. charakteristisches Merkmal Facettenzwillinge sind die eingehenden Winkel zwischen den Flächen; solche Winkel gibt es bei einzelnen ideal entwickelten Kristallen nicht. Es muss zwischen Fusionszwillingen und Keimzwillingen unterschieden werden. In der ersten sind Individuen entlang der Ebene abgegrenzt, sie scheinen miteinander in Kontakt zu sein. Zweitens überwuchern sich die Kristalle gewissermaßen oder durchdringen sich durch und durch und berühren sich entlang einer komplexen gewundenen (gestuften) Oberfläche. Zwillinge entstehen aus verschiedenen Gründen. In Lösung, wenn sich die Kristalle noch im Keimzustand befinden und sich unter Einwirkung bestimmter Kräfte relativ zueinander umdrehen. Beim Übergang von einer polymorphen Modifikation zu einer anderen. Unter mechanischen Einflüssen auf wachsende Kristalle.
falsche Kristalle–pseudomorphe
Pseudomorphose ist ein Kristall oder Korn eines Minerals, das ohne Veränderung seiner Form durch ein anderes Mineral oder eine Mischung von Mineralien ersetzt wurde, daher der Name falsche (Pseudo-) Form (Morph). Diese Formationen behalten oft sogar die kleinsten Details der Oberfläche der ursprünglichen Kristalle und Körner bei (Abb. 27).
Reis. 27. Quarz durch Asbestadern:
sogenannt "Tigerauge" - gelb und "Hawkeye" - blau
Durch Pseudomorphosen kann man die chemischen Reaktionen der Mineralbildung beurteilen, da sowohl das ursprüngliche Mineral (Korn) als auch das Endprodukt der Umwandlung gleichzeitig sichtbar sind. Unter Oberflächenbedingungen werden Pyritkristalle durch Limonit ersetzt - eine dichte braune pulverige Masse, eine Mischung verschiedener Fe 3+ -Hydroxide (Abb. 28).

Reis. 28. Limonit-Pseudomorph nach Pyritkonkretion, 4cm,
"Weiße Wüste", Ägypten
Eine andere Möglichkeit zur Bildung von Pseudomorphosen sind polymorphe Umwandlungen von Stoffen bei Temperatur- und Druckänderungen, sie werden Paramorphosen genannt. Zum Beispiel Paramorphosen von Alpha-Quarz durch Beta-Quarz ( t Transformation 575 0 С bei 100 kPa). Es gibt auch hohle pseudomorphe Abdrücke in der Gesteinsmasse von Kristallen gelöster Mineralien, deren Platz unbesetzt geblieben ist (Abb. 29).

Reis. 29. Quarz von Fluorit
Teilweiser pseudomorpher Ersatz der Oberfläche mit anschließendem Fouling der ersetzten Bereiche mit Quarzkristallen. Der Fluorit selbst wurde anschließend aufgelöst, wobei zentrale Hohlräume in Form eines negativen Würfels zurückblieben. Probe 9 cm, Kadamjai, Kirgistan.
Mineralische Zuschlagstoffe
In der Natur sind einzelne facettierte Kristalle relativ selten, häufiger bilden Mineralien verschiedene Cluster - Aggregate. In der Mineralogie werden sie normalerweise nach Morphologie unterteilt: erdig, körnig, dicht, Aggregate; Drusen, Bürsten, Sekrete, Konkretionen, Oolithe, Sphärolithe, Sinteraggregate, Dendriten, Überfälle und Schlieren.
Erdige Zuschlagstoffe sind mehlhaltige Zuschlagstoffe sehr feiner Mineralkörner. Diese Art von Aggregaten ist am häufigsten in der Erdkruste vertreten. Körnige Aggregate sind lose oder zusammenhängende Massen zufällig verwachsener Körner eines (monomineralischen) oder mehrerer (polymineralischer) Mineralien. Jedes Korn ist ein ungeschnittener, ungeformter Kristall, der unter beengten Bedingungen gewachsen ist. Je nach Korngröße werden sie in grobkörnig (>5 mm), mittelkörnig (1–5 mm), feinkörnig (<1 мм). Характерный пример – полнокристаллические магматические породы (граниты и пр.).
Reis. 30. Mittelkörniger Amazonit-Granit-Zuschlagstoff
Unter den Mineralien unterscheidet er drei Gruppen, die ein charakteristisches Aussehen von Kristallen haben:
- isometrisch, in alle drei Richtungen gleich entwickelt - Magnetit, Pyrit, Granat;
- länglich in einer Richtung, prismatisch, säulenförmig, nadelförmig und strahlend, - Schwerspat, Quarz;
- länglich in zwei Richtungen, tafelig, lamellar, blättrig und schuppig, - Chlorit usw.
Entsprechend dem Aussehen der Kristalle werden verschiedene Arten von Mineralaggregaten gebildet: blättrig (a), schuppig (b), faserig (c) und (d), radial strahlend (e), säulenförmig (f) (Abb. 31 ).
a  b
b 
in  G
G 
d  e
e 
Reis. 31. Blattaggregat - Talkum ( a), mittelschuppiges Aggregat - Paragonit ( b), langfaserige Zuschlagstoffe - Chrysotilasbest ( in), radial strahlendes Aggregat - Ägirin (d), säulenförmiges Aggregat - Kyanit (e), faseriges Aggregat - Gipsselenit (f)
Parallel säulenförmig (Abb. 31, e) und Faseraggregate (Abb. 31 in, G) bilden sich normalerweise in Rissen. Dies sind Adern aus seidigem Gips, Serpentin-Asbest, säulenförmigem Calcit. In einigen Fällen kristallisieren diese Aggregate in offenen Rissen: Zunächst wachsen Drusen nach dem Prinzip der geometrischen Selektion an den Wänden; Sie wachsen aufeinander zu, schließen sich und bilden parallele säulen- oder faserige Aggregate. In anderen werden solche Aggregate in sich allmählich öffnenden Rissen gebildet, wenn die Öffnungsrate kleiner oder gleich der Wachstumsrate von Individuen ist. Zunächst wird der Riss mit einem körnigen Mineralaggregat in Form einer durchgehenden dünnen Ader gefüllt. Wenn sich die Körner dann öffnen und aneinander anliegen, können sie nur hinter den sich ausdehnenden Wänden des Risses wachsen. Sie strecken sich allmählich normal zu den Wänden und bilden ein paralleles säulenförmiges oder faseriges Aggregat.
Gesinterte Aggregate
Sinterformen von Mineralformationen entstehen durch kolloidale Lösungen - Gele. Langsam wandernde kolloidale Lösungen, die in Hohlräume fallen, umhüllen ihre Wände, verlieren allmählich Wasser und verdicken sich. Dadurch entstehen verschiedene Formen von Aggregaten:
- Stalaktiten - hängen unter dem Einfluss der Schwerkraft von den oberen Teilen der Hohlräume;
- Stalagmiten - gebildet in den unteren Teilen der Hohlräume durch fallende Tropfen;
- nierenförmige Aggregate - die häufigsten unter den Sinterformen, treten unter Oberflächenbedingungen auf.
Die Größe solcher Formationen ist unterschiedlich: von mikroskopisch kleinen bis zu großen säulenartigen Verkrustungen in Höhlen. Eine Vielzahl von Mineralien findet sich in Sinterformen: Eisen- und Manganhydroxide, Opal, Malachit, Gips, Aragonit, Calcit etc. Sintergebilde haben im Querschnitt eine zonal-konzentrische Struktur.
Drusen (Bürsten) sind Gruppen von Kristallen, die senkrecht oder fast senkrecht zur Oberfläche von Rissen, den Wänden einer Ader oder einer Höhle in einem Gestein gewachsen sind. Erstens wachsen Einkristalle, wachsen, sie kommen miteinander in Kontakt, liegen aneinander und hindern sich am Wachsen. Es wachsen nur solche Kristalle weiter, deren Wachstumsvektor auf den freien Raum ausgerichtet ist, d.h. normal zur Rissoberfläche. Proben von Drusen sind in Abb. 1 gezeigt. 32 a und b.
a  b
b 
Reis. 32. Druse aus Quarz ( a), Pinsel aus Amethystkristallen ( b)
Sekrete entstehen, wenn ein Hohlraum im Gestein mit Mineralstoffen gefüllt ist. Oft befinden sich in der Mitte der Sekrete Drusen. Meistens Chalcedon-Sekrete mit Quarzdrusen im Inneren, beschränkt auf Tonsillen in Basalt. Sekrete mit inneren Hohlräumen werden Geoden genannt (Abb. 33).

Reis. 33. Dunkelbrauner Chalcedon-Achat mit einer Quarzdruse in der Mitte
Ein Konkrement ist ein kugelförmiges (manchmal wie abgeflachtes, unregelmäßig abgerundetes) Mineralaggregat mit radial strahlender Struktur (Abb. 34). Im Gegensatz zu Sekreten (Geoden) wachsen sie um ein Zentrum herum. In der Mitte des Konkrements befindet sich oft ein Korn, das während seines Wachstums als Samen diente. Am häufigsten bilden sich Konkretionen in porösen Sedimentgesteinen - Sanden und Tonen. Die Größe dieser Formationen reicht von Millimetern bis zu mehreren zehn Zentimetern und manchmal sogar bis zu einem Meter oder mehr. Sie sind vielfältig in Form und Struktur. Konkretionen können dicht kristallin (bestrahlt oder körnig) sein; kryptokristallin (Flint); locker und erdig (Limonit, Vivianit).
Sedimentgesteine enthalten oft Konkretionen von Pyrit, Markasit, Kieselerde (Quarz, Chalcedon, Feuerstein), Karbonate und Phosphorite. Ferromanganknollen sind von wissenschaftlichem und praktischem Interesse, sie bilden sich in großen Mengen am Meeresboden und gelten als vielversprechende Rohstoffressource der Zukunft.
Eine exotische Art von Knötchen mit karbonat-toniger Zusammensetzung, die nur in Sedimentgesteinen vorkommt und durch das Vorhandensein zahlreicher Trocknungsrisse im Inneren gekennzeichnet ist, wird Septaria genannt (Abb. 35).
. 

Reis. 34. Knoten Abb. 35. Septarien
Oolithe sind kugelförmige oder ellipsoide Gebilde aus Calciumcarbonat, Eisen- und Manganoxiden, Kieselerde usw. mit einer konzentrisch-schaligen, manchmal radial strahlenden Struktur (um den zentralen Kern herum). Der Kern kann aus Muschelfragmenten, Sandkörnern, Kieselsteinen usw. bestehen. Mineralien wie Calcit, Aragonit und Pyrolusit werden häufig in Form von Oolithen gefunden.
Oolithe werden während der Sedimentation (in Suspension, in Wasser), während der Diagenese und während anderer Stadien der Sedimentumwandlung während der Zirkulation von Lösungen in Hohlräumen gebildet. Am häufigsten bilden sich Oolithe in heißen Quellen, in bodennahen Seen und Meeresschlick.
Sie werden häufig in Kalksteinen, Eisenerzen, Bauxiten (Abb. 36), Kieselgesteinen usw. gefunden. Die Größe der Oolite reicht von Millimetern bis zu mehreren Zentimetern. Oolithe, die größer als 2–5 mm sind, werden Pisolithe genannt.

Reis. 36. Oolithischer Bauxit
Sphärolithe und nierenförmige Aggregate sind nach ihrer Morphologie benannt. Sphärolithe haben sehr oft eine fast regelmäßige Kugelform und eine Größe von Bruchteilen bis 1–2 cm oder mehr. Sie wachsen wie Kugeln auf anderen Mineralien und an den Wänden verschiedener Hohlräume in Erzen und Gesteinen. Sphärolithe entstehen entweder durch Spaltwachstum von Kristallen, oder in ihnen befindet sich wie in Konkretionen ein Nukleoluskorn, auf dem das Mineral wächst. Aufgrund der geometrischen Auswahl oder eingeschränkter Bedingungen können Kristalle nur wachsen, indem sie vom Zentrum des Sphäroliths ausstrahlen (Abb. 37).
Reis. 37. Sphärolith
Nierenförmige Aggregate bestehen aus vielen zusammenhängenden "Knospen", von denen jede wie ein Sphärolith eine radial strahlende Struktur hat (Abb. 38). Eine besonders typische Struktur haben reniforme Aggregate aus Goethit HFeO 2 H 2 O und Malachit Cu 2 (CO 3 ) (OH) 2 . Ihre Bildung fand aufgrund von Gruppenwachstum und geometrischer Selektion von Sphärolithen auf einer unebenen Oberfläche statt; nur die Sphärolithe, die sich auf den Ausbuchtungen des Substrats befanden, blieben und wuchsen. Meistens bilden sich nierenförmige Aggregate in verschiedenen Hohlräumen in oberflächennahen Zerstörungs- und Verwitterungszonen von Erzen und Gesteinen.

Reis. 38. Nierenförmiges Aggregat aus radial strahlendem Hämatit
Dendriten sind baumartige Formen, die durch das schnelle Wachstum von Kristallen in einige Richtungen gebildet werden. Sie treten auf der Oberfläche von Gesteinen entlang dünner Risse auf. Dendriten sind besonders charakteristisch für Manganoxide (Abb. 39).

Reis. 39. Dendriten von Manganoxiden (Vernadit) auf Syenit
Erdmassen sind weiche, mehlige, verborgene, körnige Formationen. Sie werden oft in Form von Krusten und Anhäufungen beobachtet, die am häufigsten bei der chemischen Verwitterung von Gesteinen und Erzen auftreten. Je nach Farbe werden erdige Massen als rußig (schwarze Massen von Manganhydroxiden), ockerartig (gelbbraune Massen von Eisenhydroxiden) bezeichnet.
